
| A、18gH2O中含有的质子数为NA |
| B、常温常压下,Na2O2与足量H2O反应,每生成1 molO2,转移电子的数目为4NA |
| C、46gNO2和N2O4混合气体中含有原子总数为3NA |
| D、物质的量浓度为0.5 mol?L-1的MgCl2的溶液中,含有Cl-个数为NA |
| m |
| M |
| 46g |
| 46g/mol |


 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、盐酸中:K+、Mg2+、Fe2+、MnO4-、 |
| B、NaOH溶液中:Cu2+、NH4+、SO42-、CO32- |
| C、FeCl3溶液中:Al3+、Na+、SCN-、SO42- |
| D、NaClO溶液中:K+、SO42-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属性:K>Na>Li |
| B、热稳定性:HI>HCl>HF |
| C、非金属性:F>O>N |
| D、碱性:NaOH>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | ||
| B、常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4NA | ||
| C、标准状况下,2.24L的CCl4中含有的C-Cl键数为0.4NA | ||
D、将CO2通过Na2O2使其增重a克时,反应中转移电子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性KMnO4溶液与H2O2反应:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| B、向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| C、向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
| D、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
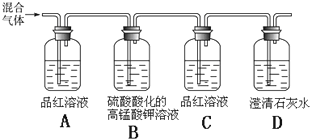
查看答案和解析>>
科目:高中化学 来源: 题型:
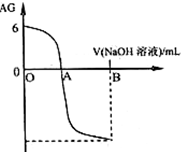 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg| c(H+) |
| c(OH-) |
| A、A点时加入氢氧化钠溶液体积为20 mL |
| B、室温时0.01 mol?L-1的醋酸溶液pH=6 |
| C、OA段溶液中:c(CH3COO-)>c(CH3COOH) |
| D、若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH)=c(OH-)-c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com