
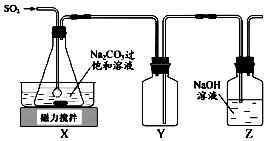
 焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.
焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中,受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如图所示.分析 在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,多余的二氧化硫可用氢氧化钠溶液吸收,因二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,
(1)向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2;
(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸;
(4)Na2S2O5易分解生成a2SO3,且Na2SO3易被氧化.
解答 解:(1)向Na2CO3过饱和溶液中通入SO2的目的是生成NaHSO3,因此反应的离子方程为2SO2+CO32-+H2O=2HSO3-+CO2↑;
故答案为:2SO2+CO32-+H2O=2HSO3-+CO2↑;
(2)由于SO2易溶于水,用NaOH溶液吸收尾气时易倒吸,故需要用Y来防止倒吸;
故答案为:防止倒吸;
(3)由于Na2S2O5是常用的抗氧化剂,在空气中,受热时均易分解,因此制取时不仅会分解生成Na2SO3,Na2SO3在空气中易被氧化生成Na2SO4,Na2SO3 (或Na2S2O5)在空气中易被氧化生成Na2SO4;
故答案为:Na2S2O5固体受热易分解生成Na2SO3,Na2SO3 (或Na2S2O5)在空气中易被氧化生成Na2SO4.
点评 本题考查物质的制备,为高考常见题型和高频考点,侧重于学生的分析、实验能力的考查,解答本题注意把握物质的性质以及题给信息,要具有扎实的实验基础知识,难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol NaH参加反应失去1mol电子 | B. | 每生成1mol H2转移2mol电子 | ||
| C. | NaH既是氧化剂,又是还原剂 | D. | NaOH是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,NA个H2O 分子所占体积约为22.4L | |
| B. | 0.1 mol H2、0.2 mol O2、0.3 mol N2和0.4 mol CO2组成的混合气体在标准状况下的体积约为22.4 L | |
| C. | 常温常压下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1 NA | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
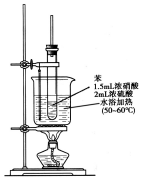 纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.
纯硝基苯是一种具有苦杏仁气味的无色油状液体,密度比水大,是制造染料的重要原料,实验室用如图所示的装置来制取.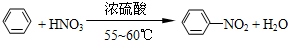 .
.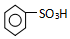 ),导致硝基苯的产率下降.写出发生副反应的化学方程式
),导致硝基苯的产率下降.写出发生副反应的化学方程式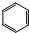 +H2SO4(浓)$\stackrel{△}{→}$
+H2SO4(浓)$\stackrel{△}{→}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
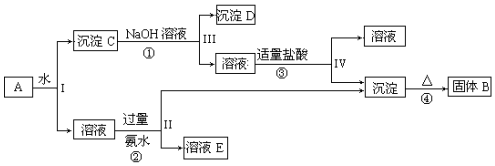
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
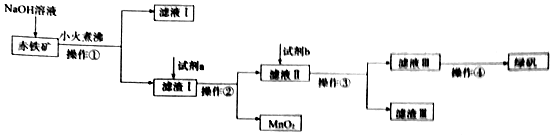
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:
电解原理在化学工业中有广泛应用.根据如图装置,回答以下问题:| 方案 | X | Y | a溶液 |
| A | 银 | 石墨 | AgNO3 |
| B | 银 | 铁 | AgNO3 |
| C | 铁 | 银 | Fe(NO3)3 |
| D | 铁 | 银 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO4 2-、HCO3 - | B. | Cu2+、K+、SO4 2-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、K+、SO4 2-、Cl - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com