
【题目】A、B为同主族的两元素,A在B的上一周期,若A的原子序数为n,则B的原子序数不能为( )
A. n+8 B. n+18 C. n+20 D. n+32
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的相对位置如下图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
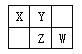
请回答下列问题:
(1)元素Z位于周期表中的位置_____________________。
(2)X、Y、Z三种元素的最高价氧化对应水化物中酸性由强到弱依次为________________(写化学式)。
(3)X和Y形成一种有毒的二元化合物,其相对分子质量在50~60之间,且其分子式中X的质量分数约为46%,该化合物的分子式为__________,该分子中各原子最外层均满足8电子稳定结构,其结构式为 ___________.
(4)写出W的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式_____________,
反应中若转移12mol电子,消耗的还原剂质量为______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的工业原料,课外小组以SO2为原料制取Na2S2O3的实验步骤如下:
I. 配制混合溶液
将Na2S和Na2CO3按2:1的物质的量之比混合,加入一定量的水,形成溶液。
II.预热、充分反应
将该溶液注入敞口反应釜中,加热反应釜一段时间,向反应釜中缓慢通入SO2至稍过量。
III.蒸发浓缩、冷却结晶
反应结束后加热浓缩溶液,冷却至30℃以下,析出大量Na2S2O3 5H2O。
IV.过滤、循环反应
滤出Na2S2O3 5H2O,烘干脱去结晶水,母液循环利用。
回答下列问题:
(1)步骤II预热时温度不宜过高,应将温度控制在50℃左右,其主要目的是____________。
(2)步骤II充分反应时的化学方程式为_______________________。
(3)步骤IV中的母液循环利用,其目的是在节约成本、减少污染的同时,提高________。
(4)为测定所得Na2S2O3产品的纯度,称取w g烘干后的Na2S2O3产品,先用适量蒸馏水溶解,再用a mol L-1碘的标准溶液滴定(2S2O32-+I2=2I-+S4O62-,且不考虑杂质与碘反应),以淀粉溶液作指示剂,滴定至终点时的现象为_________________。
若消耗碘的标准溶液的体积为b mL,则所得产品的纯度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要450mL 1mol/L的硫酸,现用密度为1.84g/㎝3,溶质的质量分数98%的浓硫酸来配制,有关说法正确的是(设NA阿伏加德罗常数的值)
A. 配制溶液时需的仪器只需要500mL容量瓶、烧杯、玻璃棒、量筒
B. 配制溶液定容时,仰视读数会使溶液的实际浓度偏大
C. 65克单质锌与一定量的该浓硫酸完全反应,生成的气体质量可能为32克
D. 配制该溶液所需浓硫酸体积为24mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2![]() P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol1、P—O b kJ·mol1、P=O c kJ·mol1、O=O d kJ·mol1。根据如图所示的分子结构和有关数据估算该反应的ΔH,下列数据正确的是
P4O10。已知断裂下列化学键需要吸收的能量分别为P—P a kJ·mol1、P—O b kJ·mol1、P=O c kJ·mol1、O=O d kJ·mol1。根据如图所示的分子结构和有关数据估算该反应的ΔH,下列数据正确的是

A.(6a+5d4c12b) kJ·mol1
B.(4c+12b6a5d) kJ·mol1
C.(4c+12b4a5d) kJ·mol1
D.(4a+5d4c12b) kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),那么此合金中一定含有的金属是
A. Na B. Mg C. Al D. Zn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的Ca2+、Mg2+、SO42- 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
![]()
(1)判断BaCl2已过量的方法是_______________________________________________。
(2)第④步中,相关的离子方程式是___________________________________________。
(3)若先用盐酸再过滤,将对实验结果产生影响,其原因是______________________________。
(4)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,其中的错误是____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知空气-锌电池的电极反应为锌片:Zn+2OH--2e-=ZnO+H2O;碳棒:O2+2H2O+4e-=4OH-,据此判断
A.锌片负极,被氧化B.锌片负极,被还原
C.石墨正极,被氧化D.石墨正极,被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com