
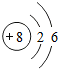 ,b的最简单氢化物的电子式为
,b的最简单氢化物的电子式为 .
.分析 a、b、c、d、e、f为原子序数依次增大的短周期主族元素,在短周期主族元素中a的原子半径最小,则a为H元素;在短周期主族元素中d的原子半径最大,则d为Na元素;e的原子序数大于Na,c、e形成的化合物为主要大气污染物之一,该化合物应该是二氧化硫,e为S元素,c为O元素,b、c是同周期相邻的元素,且质子数之和比e的质子数少1,则b为N元素,f为原子序数大于e,所以f为Cl元素;结合对应单质化合物的性质以及题目要求可解答该题.
解答 解:a、b、c、d、e、f为原子序数依次增大的短周期主族元素,在短周期主族元素中a的原子半径最小,则a为H元素;在短周期主族元素中d的原子半径最大,则d为Na元素;e的原子序数大于Na,c、e形成的化合物为主要大气污染物之一,该化合物应该是二氧化硫,e为S元素,c为O元素,b、c是同周期相邻的元素,且质子数之和比e的质子数少1,则b为N元素,f为原子序数大于e,所以f为Cl元素;
(1)c为O元素,其原子核外有8个电子,分两层排布,则O的原子结构示意图为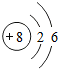 ;b为N元素,其氢化物为NH3的电子式为:
;b为N元素,其氢化物为NH3的电子式为: ;
;
故答案为: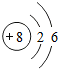 ;
; ;
;
(2)元素的非金属性越强,其氢化物越稳定,非金属性O的最强,所以气态氢化物中稳定性最强的是H2O;
故答案为:H2O;
(3)H、N、O、Cl形成的化合物中含有共价键和离子键的是铵盐,铵盐溶液显酸性,如NH4Cl,铵根离子水解的离子方程式为:NH4++H2O═NH3•H2O+H+;
故答案为:NH4Cl;NH4++H2O═NH3•H2O+H+;
(4)H和O按原子个数比1:1形成化合物H2O2的溶液中滴加几滴酸化的FeCl2溶液,会生成三氯化铁溶液,溶液变成棕黄色,发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3+是H2O2分解的催化剂,H2O2分解生成大量的氧气,同时放出热量;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3+催化H2O2分解生成大量的氧气;
(5)过氧化钠与二氧化碳反应生成的A中含碳酸钠,还可能含有没有反应的过氧化钠,
由2Na2O2+2CO2═2Na2CO3+O2、Na2CO3+2HCl═2NaCl+CO2↑+H2O、2Na2O2+4HCl═4NaCl+O2↑+2H2O,
设A中含碳酸钠的物质的量是x,过氧化钠物质的量是y,
据气体物质的量得:x+$\frac{1}{2}$y=0.3 ①
据钠、氯守恒得:2x+2y=0.8 ②,联立①②解得x=0.2 y=0.2,
故答案为:0.2molNa2O2,0.2molNa2CO3.
点评 本题主要考查了电子式、元素周期律、化学键、离子反应、根据化学方程式的计算等知识点,题目中等难度,解题的关键在于根据元素的性质确定元素种类,第(5)小问计算时注意化学计算的基本方法的运用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| B. | 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| D. | 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 方案 | 目的 |
| A | 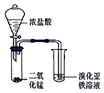 | 验证氧化性::Cl2>Br2 |
| B |  | 验证溶解度:AgCl>Ag2S |
| C | 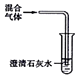 | 检验SO2、CO2混合气体中有CO2 |
| D | 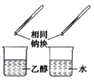 | 比较乙醇中羟基氢原子和水分子中氢原子的活泼性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
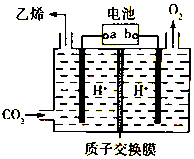
| A. | b为铅蓄电池的正极 | |
| B. | 电解过程中,阳极区溶液中c(H+)逐渐减小 | |
| C. | 阴极反应式:2CO2+12H++12e-═C2H4+4H2O | |
| D. | 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含最/mg•L-1 | 9360 | 83 | 200 | 1100 | 16000 | 1200 | 118 |
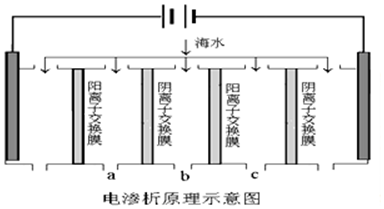
| A. | 电解一段时间后阴极区会发生反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 阳极的电极反应式为2H2O-4e-═O2↑+4H+ | |
| C. | 电解时b室中阴离子移向a室,阳离子移向c室 | |
| D. | 淡水的出口为b出口 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol D2O分子所含的中子数为8NA | |
| B. | 48 g氧气和臭氧的混合气体中的氧原子数为3NA | |
| C. | 11.2 L 甲烷(CH4)中的共价键数为2NA | |
| D. | 1 mol N2与3 mol H2反应生成的NH3分子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com