


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述I | 陈述II |
| A | SO2有漂白性 | SO2能使紫色石蕊试液褪色 |
| B | 浓硫酸具有吸水性 | 蓝色硫酸铜晶体加入到浓硫酸中变白色 |
| C | 在一定条件下铁与水可以发生反应 | 将水蒸气通过灼热的铁粉,粉末变红 |
| D | 有些反应是吸热反应 | 这些反应一定是在高温条件下发生 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1 |
| B、该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同 |
| C、降低温度,溶液的c(NH4+)/c(NH3?H3O)减小,PH降低 |
| D、往该溶液中加入足量的NH4Cl固体后,c(NH4+)+c(NH3?H3O)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
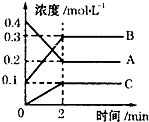 一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )
一定温度下,在2L的密闭容器中,A、B、C三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )| A、反应开始到2min,用A表示的反应速率为0.1 mol?Lˉ1?minˉ1 |
| B、反应开始到2min,B的物质的量浓度增加了0.2mol/L |
| C、反应进行到2min时,该反应停止了 |
| D、反应的化学方程式为:2A(g)?2B(g)+C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com