
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤HCO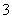 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是( )
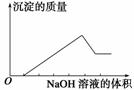
A.①②⑤ B.①③④
C.②⑥⑦ D.①②④⑥
科目:高中化学 来源: 题型:
a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种,已知:① a、c都能与稀硫酸反应放出氢气;② b和d的硝酸盐反应,置换出单质d;③ c与强碱反应放出气体;④ c、e在冷浓硫酸中发生钝化。由此可判断a、b、c、d、e依次是 ( )
A、Fe Cu Al Ag Mg B、Al Cu Mg Ag Fe
C、Mg Cu Al Ag Fe D、Mg Ag Al Cu Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH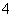 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO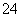 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO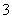
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO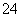
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.向NaHSO4溶液加入Ba(OH)2溶液至中性:H++SO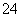 +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
B.已知Ka(HClO)>Ka2(H2CO3),则有:2ClO-+CO2(少量)+H2O===CO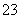 +2HClO
+2HClO
C.金溶于王水生成AuCl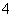 离子和NO:Au+4H++4Cl-+NO
离子和NO:Au+4H++4Cl-+NO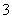 ===AuCl
===AuCl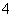 +NO↑+2H2O
+NO↑+2H2O
D.酸性条件下碘酸钾溶液与碘化钾溶液发生反应生成碘单质:IO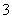 +5I-+3H2O===3I2+6OH-
+5I-+3H2O===3I2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列判断正确的是( )
A.向某溶液中加入AgNO3溶液生成白色沉淀,加入稀盐酸时沉淀不溶解,可确定溶液中有Cl-存在
B.对某溶液进行焰色反应时火焰颜色为黄色,则该溶液中一定有Na+,可能有K+
C.加入盐酸时有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有大量的CO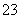 存在
存在
D.分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次性鉴别出来
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)===H2(g)+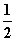 O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+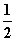 O2(g)===H2O(g) ΔH=242 kJ·mol-1
O2(g)===H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)===2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应N2+3H2
 2NH3的能量变化如下图所示,该反应的热化学方程式是( )
2NH3的能量变化如下图所示,该反应的热化学方程式是( )
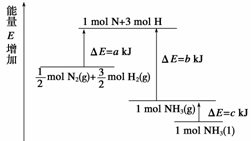
A.N2(g)+3H2(g)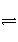
 2NH3(l) ΔH=2(a-b-c) kJ·mol-1
2NH3(l) ΔH=2(a-b-c) kJ·mol-1
B.N2(g)+3H2(g)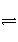
 2NH3(g) ΔH=2(b-a) kJ·mol-1
2NH3(g) ΔH=2(b-a) kJ·mol-1
C.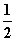 N2(g)+
N2(g)+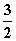 H2(g)
H2(g)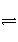
 NH3(l) ΔH=(b+c-a) kJ·mol-1
NH3(l) ΔH=(b+c-a) kJ·mol-1
D.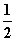 N2(g)+
N2(g)+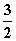 H2(g)
H2(g)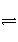
 NH3(g) ΔH=(a+b) kJ·mol-1
NH3(g) ΔH=(a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是在一定温度下,向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流强度(I)随新物质加入量(m)的变化曲线,以下四个导电性实验,其中与A图变化趋势一致的是__________,与B图变化趋势一致的是__________,与C图变化趋势一致的是________。
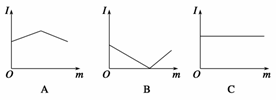
①氢氧化钡溶液中滴入硫酸溶液至过量;
②醋酸溶液中滴入氨水至过量;
③澄清石灰水中通入CO2至过量;
④氯化铵溶液中逐渐加入适量氢氧化钠固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
在常温下,下列五种溶液:①0.1 mol·L-1 NH4Cl ②0.1 mol·L-1 CH3COONH4
③0.1 mol·L-1 NH4HSO4 ④0.1 mol·L-1 NH3·H2O和0.1 mol·L-1 NH4Cl混合液
⑤0.1 mol·L-1 NH3·H2O。
请根据要求填写下列空白:
(1)溶液①呈________性(填“酸”、“碱”或“中”),其原因是________________________(用离子方程式表示)。
(2)在上述五种溶液中,pH最小的是________;c(NH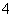 )最小的是________(填序号)。
)最小的是________(填序号)。
(3)比较溶液②、③中c(NH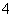 )的大小关系是②________③(填“>”“<”或“=”)。
)的大小关系是②________③(填“>”“<”或“=”)。
(4)在溶液④中,__________的浓度为0.1 mol·L-1;NH3·H2O和__________的物质的量浓度之和为0.2 mol·L-1。
(5)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”“<”或“=”)NH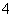 的水解程度,CH3COO-与NH
的水解程度,CH3COO-与NH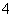 浓度的大小关系是:c(CH3COO-)________c(NH
浓度的大小关系是:c(CH3COO-)________c(NH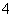 )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com