
下列实验方案设计不合理的是
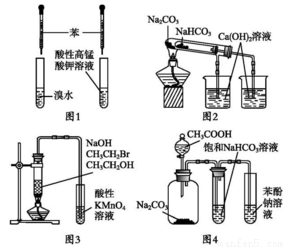
A.图1:验证苯中是否有碳碳双键
B.图2:验证NaHCO3和Na2CO3的热稳定性
C.图3:验证溴乙烷发生消去反应生成烯烃
D.图4:验证酸性CH3COOH>H2CO3>C6H5OH
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:选择题
下列说法错误的是
A.0.1 mol/L CH3COOH溶液中:c(CH3COO-)+c(CH3COOH)=0.1mol/L
B.将Al2(SO4)3溶液蒸干,灼烧得Al2O3
C.配制FeCl3溶液,应加少量盐酸
D.Na2S溶液中:c(OH-)=c(H+) + c(HS-) + 2c(H2S)
查看答案和解析>>
科目:高中化学 来源:2016届江西省、临川二中高三下联考理综化学试卷(解析版) 题型:实验题
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:

(1) NaClO的电子式是
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是
(3)途径I碱浸时发生反应的化学反应方程式为
(4)途径Ⅱ氧化时发生反应的离子方程式为
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:

①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为____。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是____。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三下学期周考五理科综合化学试卷(解析版) 题型:选择题
下列实验能达到预期目的是( )
编号 | 实验内容 | 实验目的 |
A | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 | 证明非金属性S>C |
B | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入NaI固体,产生黄色沉淀 | 证明难溶物存在沉淀溶解平衡 |
C | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
查看答案和解析>>
科目:高中化学 来源:2016届安徽省六安市高三下综合训练十理综化学试卷(解析版) 题型:实验题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,不会造成二次污染。
己知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
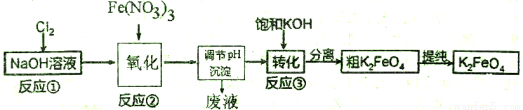
(1)①上述氧化过程中,发生反应的离子方程式是__________,在实际生产中一般控制反应温度30℃以下,其原因是__________。
②沉淀过程中加入浓KOH溶液可析出高铁酸钾(K2FeO4 ),这说明__________。
③在提纯K2FeO4中采用重结晶、洗涤、低温烘干的方法,沉淀洗涤方法是__________。
④某温度下,将C12通入NaOH溶液中,反应后得到NaCl,NaC1O,NaClO3的混合溶液,经测定ClO-与C1O3-离子的物质的量之比是1: 2,则C12与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为__________。
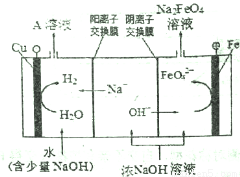
(2)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为__________,其中可循环使用的物质是__________。
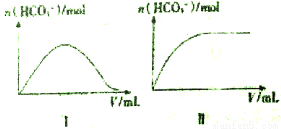
(3)CO2可转化为碳酸盐,其中Na2CO3是一种用途广泛的碳酸盐.己知:25℃时,几种酸的电离平衡常数如下表所示。

25℃时,向一定浓度的Na2CO3溶液中分别滴入等物质的量浓度的下列溶液至过量:
①NaHSO3②HNO3③HC1O,溶液中的n (HCO3-)与所加入溶液体积(V)的关系如上图所示。其中符合曲线Ⅱ的溶液为__________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:填空题
A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的第一电离能低于同周期左右相邻元素 |
B | B原子中成对电子数等于未成对电子数的2倍 |
C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:________。
(2)写出E元素的元素符号:________,其价电子排布图为:________。
(3)A与D形成化合物的化学式为________,是________分子(填“极性”或“非极性”)
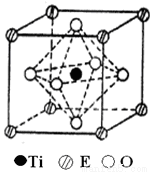
(4)在ETiO3晶胞中(结构如图2所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为________个、________个.
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3-.N3-的空间构型为________,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是________,E的配位数是________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:选择题
钡在氧气中燃烧时得到一种钡的氧化物晶体,其晶胞为立方体,结构如图所示,有关说法不正确的是
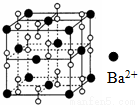
A.晶体的化学式为Ba2O2
B.该晶体属于离子晶体
C.该晶体晶胞结构与NaCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁鞍山一中高二下期中化学试卷(解析版) 题型:选择题
二茂铁[(C5H5) 2Fe]是由一个二价铁离子和2个环戊烯基负离子构成,已知:二茂铁熔点是173℃(在100℃时开始升华),沸点是249℃,不溶于水,易溶于苯、乙醚等非极性溶剂。下列说法正确的是
A.二茂铁属于离子晶体
B.在二茂铁结构中,C5H5-与Fe2+之间形成的化学键类型是离子键
C.己知:环戊二烯的结构式为: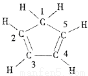 ,则其中仅有1个碳原子采取sp3杂化
,则其中仅有1个碳原子采取sp3杂化
D.二价铁离子的基态电子排布式为:[Ar]3d44s2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃会宁一中高一下期中文科化学试卷(解析版) 题型:选择题
在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( )
A.合金 B.半导体 C.催化剂 D.农药
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com