
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )

A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
科目:高中化学 来源: 题型:
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
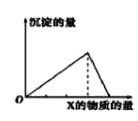
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+ H2O2+ BaCl2= BaSO4↓+ 2HC1 ,用NA表示阿伏加德罗常数的值,下列说法不正确的是
A. 0.1 molBaCl2中所含离子总数约为0.3 NA
B. 25℃时,pH=l的HC1溶液中含有H+的数目约为0.1 NA
C. 标准状况下,17gH2O2中所含电子总数约为9 NA
D. 生成2.33gBaSO4沉淀时,吸收SO2的体积在标准状况下约为0.224L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一中重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示。请回答下列问题:
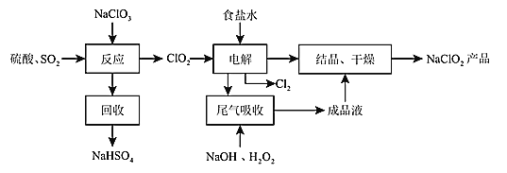
(1)NaClO2中Cl元素的化合价为_____________;
(2)写出“反应”步骤中生成ClO2的化学方程式________________________。
(3)“尾气吸收”步骤中发生的反应为2NaOH + H2O2 + 2ClO2 = 2NaClO2 + O2↑ + 2H2O ,其中氧化剂与还原剂的物质的量之比为_________;若有3 mol 电子发生转移,则有__________L(标准状况下)O2生成。
(4)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,是指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。则NaClO2的有效氯含量为_____(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个容积为V的密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2molCO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在KNO3固体样品中含有少量的KCl、BaCl2杂质,为了提纯KNO3并分离得到BaCl2,进行如下实验操作:
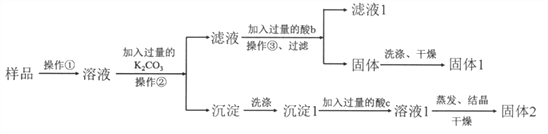
(1)加入过量K2CO3所发生反应的离子方程式为_________________________________;
(2)结合下图各物质的溶解度曲线可知操作③的名称是_________________;
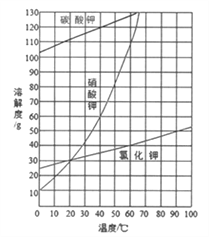
(3)有人认为操作③之前无需加入过量的酸b,也能得到纯净的固体1,你认为该观点是否正确?并做出解释______________________________________。
(4)用制得的 KNO3固体配制 200 mL0.2mol/L KNO3 溶液。
①本实验用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、量筒、还有_______________;
②下列情况会使所配制的KNO3 溶液的浓度偏高的是______________(填字母)。
A.没有洗涤烧杯和玻璃棒 B.容量瓶不干燥,含有少量蒸馏水
C.定容时仰视刻度线 D.定容时俯视刻度线
E.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,对可逆反应A+3B![]() 2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是
2C(g),平衡时C的体积分数与温度和压强的关系如图所示,下列判断错误的是

A.若正反应方向Q<0,则T1>T2
B.A可能为气体
C.压强增大时,混合气体的平均相对分子质量增大
D.B不一定为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯的合成路线如下图所示

(1)反应Ⅰ反应类型为___________________; D中含氧官能团为_____________写名称)。
(2)反应Ⅱ的反应条件为:_________________。
(3)C→D的化学反应方程式为________________________________________。
(4)写出一种满足下列条件的E的同分异构体的结构简式为__________________________。
①能发生银镜反应 ②含苯环且苯环上一溴代物两种 ③不能与钠反应
(5)写出B合成![]() 的合成路线。合成路线常用的表示方式为:_______________
的合成路线。合成路线常用的表示方式为:_______________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
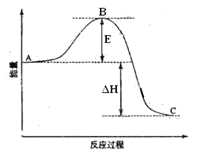
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热__________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”),△H_____(填“变大”、“变小”或“不变”)理由是________________;
(2)图中△H =_______kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式_______________________________。
(4)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3molSO3(g)的△H(写出计算过程):________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com