
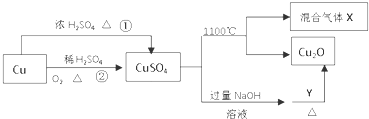
| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖 | |
| C. | CuSO4在1100℃分解所得混合气体X可能是SO2和SO3 | |
| D. | CuSO4可用于配制农药 |
分析 A.根据反应物和生成物的化学式判断,途径①产生二氧化硫气体污染性气体;
B.硫酸铜与氢氧化钠生成氢氧化铜沉淀,与Y生成氧化亚铜,知Y可为葡萄糖,因葡萄糖中有醛基;
C.硫酸铜分解生成Cu2O与氧气、SO2、SO3,依据电子守恒、原子守恒分析;
D.CuSO4可用于配制农药如农药波尔多液.
解答 解:A.相对于途径①,铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成的二氧化硫气体污染空气,途径②2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO;CuO+H2SO4(稀)=CuSO4+H2O,优点:制取等质量胆矾需要的硫酸少、途径2无污染性气体产生,更好地体现了绿色化学思想,故A正确;
B.葡萄糖与氢氧化铜反应的方程式为:C6H12O6+2Cu(OH)2=C6H12O7+Cu2O+2H2O,所以Y可为葡萄糖,故B正确;
C.硫酸铜分解生成Cu2O与氧气、SO3、SO2,根据2CuSO4$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O+SO2↑+SO3↑+O2↑知,X可能是O2、SO2和SO3的混合气体,若只是二氧化硫和三氧化硫,铜元素、氧元素化合价只有降低,无元素化合价升高,故C错误;
D.CuSO4可用于配制农药,如农药波尔多液是一种农业上常用的杀菌剂,它是由硫酸铜、生石灰加水配制而成,故D正确;
故选C.
点评 本题考查了物质的制备,解题的关键是掌握物质的性质,解答时要依据题干提供信息,结合相关知识细心分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Fe3+、NH4+、HCO3-、SO42- | B. | H+、Fe2+、ClO-、Cl- | ||
| C. | Mg2+、Na+、SO42-、NO3- | D. | Al3+、Ag+、OH-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00
如图所示,25℃时,在烧杯A中装有50.00ml蒸馏水,烧杯B 中盛有50.00查看答案和解析>>
科目:高中化学 来源: 题型:选择题
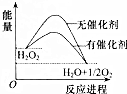 已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )
已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如图所示.下列说法正确的是( )| A. | 反应物的总能量高于生成物的总能量 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+O2;△H=-Q1 kJ•mol-1 | |
| D. | 加入催化剂,减小了反应的热效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe2+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ClO-作氧化剂 | |
| B. | FeO42-为还原产物 | |
| C. | 每产生1 mol FeO42-,转移3 mol电子 | |
| D. | OH-作氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为2NA | |
| B. | 7 g CnH2n中含有的氢原子数目为NA | |
| C. | 任何气体单质在标况下体积若为22.4L,则含有2NA个原子 | |
| D. | 1mol Na2O2与水反应转移的电子数约为1.204×1024个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com