
 H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-=40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 标况下,当有22.4LH2S参与反应时,有2mo1H+经质子膜进入负极区 |
分析 根据2H2S(g)+O2(g)═S2(s)+2H2O反应,得出负极H2S失电子发生氧化反应,正极O2得电子发生还原反应,溶液中阳离子向正极移动,据此分析解答.
解答 解:A、原电池是把化学能转化为电能的装置,但是化学能不能全部转化为电能,有部分化学能转化为热能等其它形式的能量,故A错误;
B、正极O2得电子发生还原反应,酸性条件下,氧气得电子生成水,则电极b上发生的电极反应为:O2+4H++4e-=2H2O,故B错误;
C、a极为负极,负极上硫化氢失电子生成S2和氢离子,则电极a上发生的电极反应为:2H2S-4e-═S2+4H+,故C正确;
D、标况下,当有22.4LH2S即1molH2S参与反应,则消耗0.5mol氧气,则根据O2+4H++4e-=2H2O,所以有2mol H+经质子膜进入正极区,故D错误;
故选:C.
点评 本题侧重考查原电池原理,明确电解质溶液酸碱性是解本题关键,难点是电极反应式的书写,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
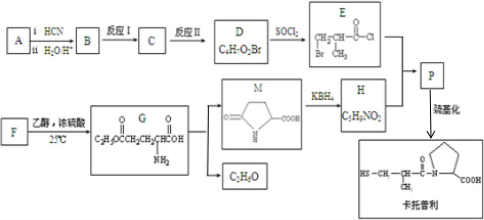
 (R1、R2为烃基)
(R1、R2为烃基)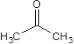 .
. ,反应Ⅱ所用试剂是HBr.
,反应Ⅱ所用试剂是HBr. .
. .
. (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

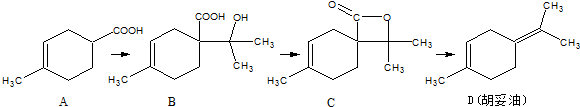
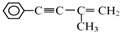 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.
 或
或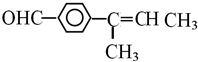 (任写一个)
(任写一个)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理使用化肥可以提高农作物的产量 | |
| B. | 二氧化氯、臭氧均可用作自来水消毒剂 | |
| C. | 氢氧化铝和碳酸钠均可用于治疗胃酸过多 | |
| D. | 化妆品中的甘油可起到保湿滋润皮肤的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑦ | B. | ②⑤⑧ | C. | ②③④⑥ | D. | ①②④⑤⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com