
| A. | 用HA溶液做导电实验,灯泡很暗 | |
| B. | HA和CaCO3发生反应放出CO2 | |
| C. | pH=2的HA溶液稀释至100倍,pH小于4 | |
| D. | pH=3的HA溶液中水电离出的c(H+)为10-11mol•L-1 |
分析 要证明一元酸HR为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
解答 解:A.用HA溶液做导电实验,灯泡很暗,说明该溶液中离子浓度较低,但不能说明HA部分电离,所以不能证明HA是弱酸,故A错误;
B.HA能和碳酸钙反应生成二氧化碳说明HA酸性大于碳酸,但不能说明HA部分电离,所以不能证明HA是弱酸,故B错误;
C.pH=2的HA溶液稀释至100倍,pH小于4,说明稀释过程中HA发生电离,则HA为弱电解质,故C正确;
D.常温下,无论HA是强酸还是弱酸,pH=3的HA溶液中水电离出的c(H+)=c(OH-)=10-11mol•L-1,不能说明HA部分电离,所以不能证明HA是弱酸,故D错误;
故选C.
点评 本题考查强弱电解质的判断,为高频考点,强弱电解质的根本区别是电离程度,与物质溶解性强弱、溶液导电性强弱无关,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中马上泛起大量泡沫 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 工业上生产硫酸的过程中,二氧化硫在接触室氧化时通入过量空气(O2) | |
| D. | 工业合成氨时常用通过量氮气的方法提高氢气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中Fe2+是还原剂,O2是还原产物 | |
| B. | 4 mol Na2O2在反应中共得到8NA个电子 | |
| C. | 每生成4 mol Fe(OH)3反应过程中共转移电子6 mol | |
| D. | 反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S既作氧化剂又作还原剂 | B. | 消耗12gC时,反应转移5mol电子 | ||
| C. | 还原产物只有K2S | D. | KNO3只发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体材料碳化硅 | B. | 超导材料铜锌合金 | ||
| C. | 透明陶瓷材料硒化锌 | D. | 超导材料Cs3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种
,A的名称是2-甲基戊烷. 若A是炔烃B氢化而成,则B的结构有2种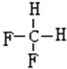 和
和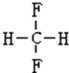 F.
F.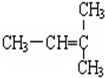 和
和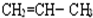 G.
G.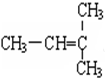 和
和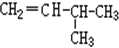
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液的pH=4 | |
| B. | 适当升高温度,溶液的pH不变 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 由HX电离出的c(H+)约为水电离出的c(OH-)的106倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
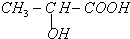 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com