
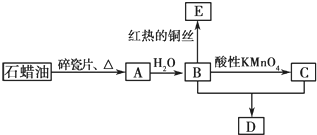
| 催化剂 |
| 加热加压 |
| 浓H2SO4 |
| △ |
| Cu |
| △ |
| 催化剂 |
| 加热加压 |
| 浓H2SO4 |
| △ |
| Cu |
| △ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、铝制容器不能盛装酸性溶液,可以盛装碱性溶液 |
| B、金属钠着火时,可用细沙覆盖灭火 |
| C、硫酸的消费量是衡量一个国家化学工业发展水平的标志 |
| D、碳酸氢钠是焙制糕点所用的发酵粉的主要成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 (其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B.
(其中R、R1、R2、R3和R4均表示烃基)今有A~K等11种不同的有机物,它们之间的转化关系如下.其中A为烃,1mol A可得2mol B.
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、图1的干燥烧瓶中盛有CO2,烧杯和滴管内盛有饱和NaHCO3溶液,挤压胶管的胶头会形成无色喷泉 |
| B、图2中若X为碳棒,开关K置于N处,铁极的反应:Fe-2e-═Fe2+ |
| C、图3中装置(Ⅰ)为一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图.当闭合开关K时,电极X附近溶液先变红,则电极B发生了还原反应 |
| D、用图4验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色透明的溶液:Fe3+、K+、OH-、NO3- |
| B、与Al反应生成H2的溶液:Na+、Ma2+、NO3-、HCO3- |
| C、c(OH-)=1mol/L的溶液:K+、Ca2+、Cl-、H2SO3 |
| D、CH3COOH:SO42-、Cl-、Cu2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:
(1)已知:2SO3(g)?2SO2(g)+O2(g),在起始时体积相同的容器A和B中同时分别充入2mol SO3(两容器装有催化剂).在反应过程中,A保持温度和容积不变;B保持温度和压强不变.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A、一定没有Cu2+、NO3-、Cl- |
| B、可能有K+、NH4+、NO3-、SO42- |
| C、不能确定是否含有K+、NO3- |
| D、一定有Mg2+、Al3+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com