
| A. | 阳光透过墙上的小孔在较暗的房间里形成一道道光柱 | |
| B. | 用石膏或盐卤制豆腐 | |
| C. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| D. | 长江三角洲的形成 |
分析 A.气溶胶具有丁达尔现象;
B.胶体加入电解质发生聚沉;
C.红褐色沉淀是生成的氢氧化铁,不是胶体;
D.江河入海口三角洲的形成是胶体聚沉的结果.
解答 解:A.阳光透过墙上的小孔在较暗的房间里形成一道道光柱、,是胶体的丁达尔现象,与胶体有关,故A正确;
B.用石膏或盐卤点制豆腐,利用的是胶体的聚沉,和胶体性质有关,故B正确;
C.在FeCl3溶液中滴加NaOH溶液出现红褐色沉淀,发生的是复分解反应,与胶体无关,故C错误;
D.江河中的泥浆属于胶体,江河入海口三角洲的形成是胶体聚沉的结果,和胶体性质有关,故D正确.
故选C.
点评 本题考查了胶体性质的应用,主要考查胶体的聚沉、胶体的分散质微粒直径,丁达尔现象,熟练掌握胶体性质是解题关键,较简单.


科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 向NaOH溶液中通入足量CO2:CO2+OH-═HCO3- | |
| C. | FeBr2溶液中通入足量氯气:Fe2++2Br-+2 Cl2═Fe3++Br2+4Cl- | |
| D. | 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-═Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
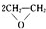
| 乙炔水化法 | 乙烯氧化法 | |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| 原料生产工艺过程 | |
| 乙炔 | CaCO3$\stackrel{①850-1100℃}{→}$CaO$→_{1100℃}^{②+C、电炉}$CaC2$\stackrel{③饱和食盐水}{→}$C2H2 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 杂质 | 除杂试剂 |
| A | FeCl3(aq) | Al3+(aq) | NaOH溶液、盐酸 |
| B | AlCl3(aq) | Cu2+ | Al粉 |
| C | NaHCO3(aq) | Na2CO3(aq) | CO2气体 |
| D | FeCl3(aq) | Cu2+ | Fe粉 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Mg2+ | Cr3+ | Cl- |
| 浓度(mol/L) | 0.5 | 0.01 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com