
【题目】硫酸盐和金属硫化物在工农业生产中有广泛的应用。
(1)已知:
反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g) △H2=-175.6kJ·mol-1
反应 Ⅲ:3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) (B) △H3
①△H3=__________。
②能使反应Ⅰ、Ⅱ速率加快的措施有____________________________________(写出两条)。
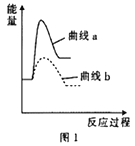
③已知某温度下反应Ⅰ的反应速率小于反应Ⅱ的反应速率,则图1中曲线a表示__________ (填“反应Ⅰ”或“反应Ⅱ”)。
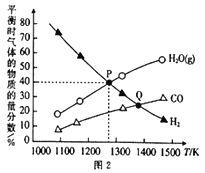
(2)在2L密闭容器中,加入0.1molMoS2(硫化钼)、0.2molNa2CO3和0.4molH2,发生反应MoS2(s)+2Na2CO3 (s)+4H2(g)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),达到平衡时三种气体的物质的量分数随温度变化的曲 线如图2所示。
①反应速率:P点______ Q点(填“<” “>”或“=”),其判断理由是_____________。
②气体总压:P点__Q点(填“<” “>”或“=”),其判断理由是_____________。
③P点对应温度下,H2的平衡转化率为__________,平衡常数K=__________。
【答案】 +1049.2kJ·mol-1 增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等(写出其中的任意两条 反应Ⅰ < 从P点到Q点,温度升高,反应速率加快 < 从P点到Q点,温度升高,平衡向正反应方向移动,密闭容器中气体分子数增多 50% 2.5×10-3
【解析】试题分析:(1) ①根据盖斯定律计算△H3;②根据影响反应速率的因素分析;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;(2) ①Q点温度大于P点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多;③利用“三段式”计算;
解析:(1) ①反应Ⅰ:CaSO4(s)+CO(g)=CaO(s)+SO2(g)+CO2(g)△H1=+218.4 kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g)=CaS(s)+4CO2(g)△H2=-175.6kJ·mol-1
根据盖斯定律Ⅰ![]() -Ⅱ得3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)(B)△H3=+1049.2kJ·mol-1;②能使反应Ⅰ、Ⅱ速率加快的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;曲线a是表示吸热反应,所以曲线a是表示反应Ⅰ;(2) ①温度越高,反应速率越快,Q点温度大于P点,所以反应速率:P点<Q点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多,所以气体总压:P点<Q点;③P点对应温度下,氢气、水的体积分数相同,则
-Ⅱ得3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g)(B)△H3=+1049.2kJ·mol-1;②能使反应Ⅰ、Ⅱ速率加快的措施有增大反应体系压强、升高温度、加入催化剂、将固体硫酸钙碾碎等;③反应Ⅰ是吸热反应、反应Ⅱ是放热反应;曲线a是表示吸热反应,所以曲线a是表示反应Ⅰ;(2) ①温度越高,反应速率越快,Q点温度大于P点,所以反应速率:P点<Q点;②从P点到Q点,氢气的含量减小,平衡正向移动,密闭容器中气体分子数增多,所以气体总压:P点<Q点;③P点对应温度下,氢气、水的体积分数相同,则
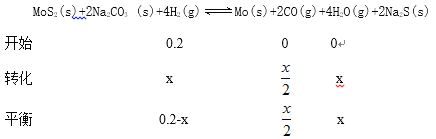
![]()
X=0.1
H2的平衡转化率为![]() ;平衡常数K=
;平衡常数K=![]() 2.5×10-3 。
2.5×10-3 。


科目:高中化学 来源: 题型:
【题目】氯及其化合物在工农业生产和日常生活中有着广泛的用途。
Ⅰ.实验室用下图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4。已知K2FeO4具有下列性质①可溶于水、微溶于浓KOH溶液,②在0℃~5℃、强碱性溶液中比较稳定。
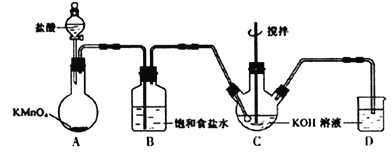
(1)装置A中的玻璃仪器的名称分别是___________。
(2)装置A中KMnO4与盐酸反应生成KCl、MnCl2和Cl2,其离子方程式为_______________________。将制备的Cl2通过装置B可除去___________ (填化学式)。
(3)Cl2和KOH在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是___________________。
Ⅱ.某学习小组用下图装置制取并收集ClO2。(已知无水草酸在100℃可以升华)
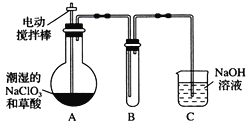
(1)实验时装置A需在60℃~100℃进行的原因是_________________________。
(2)电动搅拌棒的作用是_______________________。
(3)装置A中反应产物有Na2CO3、ClO2和CO2等,用ClO2处理过的饮用水(pH为5.5~6.5)往往残留少量ClO2和一定量对人体不利的亚氯酸根高子(ClO2-)。
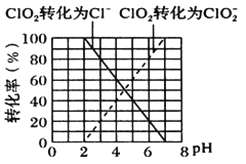
①ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示
②当pH≤2.0时,写出ClO2被I-还原的离子方程式________________________________。
③当pH为7.0~8.0时,ClO2的还原产物为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,加入等物质的量的NO和O2,800℃时发生反应:2NO(g)+O2(g)→2NO2(g),其中n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。
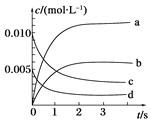
(3)用O2表示从0~2s内该反应的平均速率v=________,5s时O2的转化率为_____________。
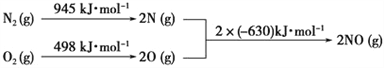
(4)NOx是汽车尾气中的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化如图所示。写出该反应的热化学方程式:_______________________。
(5)以N2和H2为反应物,盐酸酸化的NH4Cl溶液为电解质的原电池,工作原理如下图所示,下列说法不正确的是___________。
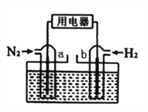
A.b电极为负极
B.反应过程中,溶液中的Cl-向a电极移动
C.a电极的电极反应式为:N2+6e-+8H+=2NH4+
D.电池反应为N2+3H2+2HCl=2NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X均为短周期元素形成的无机物,存在下图所示转化关系(部分生成物和反应条件略去)。请回答以下问题:
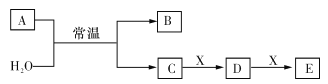
(1)若A是短周期非金属元素R的单质,B具有漂白性且光照易分解,C为一元强酸。
①元素R在元素周期表中的位置为________________________。若元素Q与元素R的最外层电子数相同且Q的原子半径更小,则两者的简单氢化物的沸点更高的是_________(填“R”或“Q”),原因是______________________________。
②写出实验室制备单质A的反应的离子方程式__________。
③X可能为________(填字母代号)。
a.NaOH b.AlCl3 c.Na2CO3
(2)若A是淡黄色固体,请写出以C为电解质溶液的氢氧燃料电池的负极的电极反应方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法错误的是( )
A. 标准状况下,22.4L 由 N2 和 N2O 组成的混合气体中,所含有的氦原子的物质的量为 2mol
B. 1.7g NH3 含有的质子数为 NA
C. 标准状况下,11.2L 氦气和氢气的混合气含有的分子数为 0.5NA
D. 1L 0.1mol/LCH3CH2OH 水溶液中含 H 原子数目为 0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法不正确的是
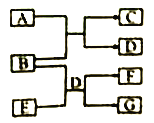
A. 阴离子半径;Y>Z>X
B. 沸点:D<A
C. 气态氢化物稳定性:Z>Y
D. 0.1mol·L-1A溶液中:e(H-)>c(HY-)>e(Y2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是( )
A.乙烯使溴水褪色
B.将苯滴入溴水中,振荡后水层接近无色
C.乙烯使酸性KMnO4溶液褪色
D.甲烷与氯气混合,光照后黄绿色消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com