
| A. | 1molH2燃烧放出的热量为H2的燃烧热 | |
| B. | Na2SO3和H2O2的反应为氧化还原反应 | |
| C. | 若某反应的反应物总能量低于生成物总能量,则该反应为放热反应 | |
| D. | BaSO4的水溶液不导电,故BaSO4是弱电解质 |
分析 A、在25℃和101kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热;
B、有化合价变化的为氧化还原反应;
C、反应物总能量低于生成物总能量,则该反应为吸热反应;
D、溶解的少量BaSO4在水溶液中完全电离.
解答 解:A、1molH2燃烧生成稳定的1molH2O(1)放出的热量为H2的燃烧热,故A错误;
B、Na2SO3和H2O2的反应生成硫酸钠和水,硫的化合价升高,氧的化合价降低,所以为氧化还原反应,故B正确;
C、若某反应的反应物总能量低于生成物总能量,则该反应为吸热反应,故C错误;
D、虽然硫酸钡溶剂性很小,但溶解的少量BaSO4在水溶液中完全电离,则BaSO4是强电解质,故D错误.
故选B.
点评 本题考查学生有关化学概念和原理的知识,是一道基本知识题目,较简单.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液和CO2反应 | B. | Cu(OH)2溶液和稀H2SO4反应 | ||
| C. | 氢氧化钡溶液和硝酸反应 | D. | 氨水和稀H2SO4反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 236 kJ•mol-1 | B. | -116 kJ•mol-1 | C. | -236 kJ•mol-1 | D. | 116 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
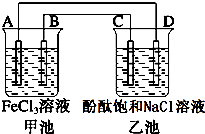 如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:
如图所示,甲池中电池反应式为2Fe3++Cu═2Fe2++Cu2+,反应过程中A电极质量逐渐减小,C、D为石墨电极,乙池中为200mL滴加酚酞的饱和NaCl溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀硫酸除去铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| B. | Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| C. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3•H2O+2BaSO4↓ | |
| D. | 少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
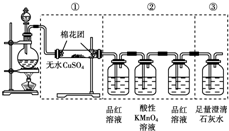
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
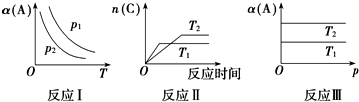
| A. | 在图象反应Ⅰ中,说明正反应为吸热反应 | |
| B. | 在图象反应Ⅰ中,若p1>p2,则此反应的△S>0 | |
| C. | 在图象反应Ⅱ中,说明该正反应为吸热反应 | |
| D. | 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com