
【题目】关于如图所示转化关系(X代表卤素),说法不正确的是( )
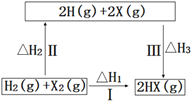
A.2H(g)+2X(g)=2HX(g) △H3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以△H1=△H2+△H3
C.途径Ⅰ生成HBr放出的热量比生成HCl的少,说明HBr比HCl稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次减小
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
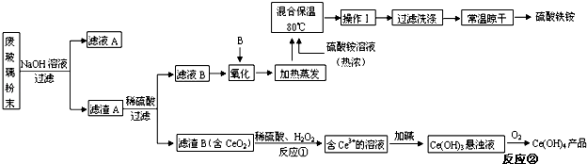
已知:
①酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce3+易水解,Ce4+有较强氧化性。
②CeO2不溶于稀硫酸。
③硫酸铁铵[aFe2(SO4)3b(NH4)2SO4cH2O]广泛用于水的净化处理。
(1)在氧化环节,下列物质中最适合用作氧化剂B的是 (填序号)。
a.NaClO b.H2O2 c.KMnO4
(2)操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是 。
(3)写出反应②的化学方程式 。
(4)用滴定法测定制得的Ce(OH)4产品纯度。称取Ce(OH)4样品→加硫酸溶解→用0.1000mol/LFeSO4溶液滴定,所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5)称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。通过计算,该硫酸铁铵的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,环境保护、食品安全越来越受到人们的关注。
(1)保护环境、保护地球是人类共同的呼声,试回答下列问题:
①为确保空气质量优良率达到95%以上 ,空气质量状况监测中,不需要监测的指标是(________)
A.可吸入颗粒物(pm2.5) B.NO2 浓度 C.SO2浓度 D.CO2浓度
②造成臭氧层空洞的主要物质是_____________________。
③绿色世博,亮点之一是二氧化碳零排放。为了适应低碳生活,参观世博园最好是 __________(A.驾私家车 B.乘公交车);世博停车场,安装有汽车尾气催化光解设施。 写出汽车尾气中CO、NO相互作用生成可参与大气循环的两种气体的化学方程式:
____________________________________________________________________。
(2)随着生活水平的提高,人们越来越关注自身的健康。以下是探讨化学物质与人体健康 的有关问题:微量元素与人体健康密切相关,若膳食结构不合理,摄入某种微量元素不 足,就会引起某些疾病,例如甲状腺肿大(俗称大脖子病),可能是由于缺_________,人体铁元素摄人量不足可能会导致______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国格勒诺布尔(Grenoble)约瑟夫·傅立叶大学的研究小组发明了第一块可植入人体为人造器官提供电能的葡萄糖生物燃料电池,其基本原理是葡萄糖和氧气在人体中酶的作用下发生反应:C6H12O6+6O2![]() 6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
6CO2+6H2O(酸性环境)。下列有关该电池的说法不正确的是( )
A. 该生物燃料电池不可以在高温下工作
B. 电池的负极反应为C6H12O6+6H2O-24e-=6CO2↑+24H+
C. 消耗1 mol氧气时转移4 mol e-,H+向负极移动
D. 今后的研究方向是设法提高葡萄糖生物燃料电池的效率,从而使其在将来可以为任何可植入医疗设备提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中充入一定量的NO2,发生反应2NO2(g)![]() N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )
N2O4(g)ΔH=﹣57 kJmol﹣1在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>cB. a、b两点的转化率:a<b
C. a、c两点气体的颜色:a深,c浅D. 由a点到b点,可以用加热的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表达正确的是
A. NaHS的电离:NaHS = Na+ + H+ + S2-
B. 把金属铁放入稀硝酸中: Fe + 2H+ = Fe2+ + H2↑
C. NaHCO3溶液与少量的澄清石灰水反应:HCO3- + OH- + Ca2+ = CaCO3↓+ H2O
D. HClO的电离:HClO ![]() H+ + ClO-
H+ + ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种溶液中,室温下由水电离生成的H+浓度之比(①:②:③:④)是( )
①pH=0的盐酸 ②0.1molL﹣1的盐酸 ③0.01molL﹣1的NaOH溶液④pH=11的NaOH溶液.
A.1:10:100:1 000B.0:1:12:11
C.14:13:12:11D.14:13:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为_______。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是____________(用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)![]() H=-1118 kJ·mol-1
H=-1118 kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)![]() H=-1675.7 kJ·mol-1
H=-1675.7 kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为______________。
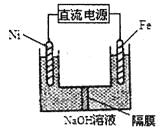
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式______。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是______________。
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是____________。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为____。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]=______。
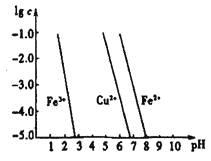
已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度![]() 10-5mol·L-1时,可认为沉淀完全)。
10-5mol·L-1时,可认为沉淀完全)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化如图示。1molN2和1molO2完全反应生成NO会____(填“吸收”或“放出”)____kJ能量。

(2)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是___________反应(填“氧化”或“还原”)。
②外电路中,电子是从_________电极流出(填“NiO”或“Pt”).
③Pt电极上的电极反应式为________________________。
(3)一种新型催化剂用于NO和CO的反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度 (mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
①请将表中数据补充完整:a ___________。
②能验证温度对化学反应速率规律的是实验____________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______(填“甲”或“乙”)。

(4)在容积固定的绝热容器中发生反应2NO+2CO2CO2+N2,不能说明已达到平衡状态的是________(不定项选择);
A.容器内混合气体温度不再变化 B.容器内的气体压强保持不变
C.2υ逆(NO)=υ正(N2) D.容器内混合气体密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com