
| A. | MgCO3与盐酸反应:CO32-+2H+=CO2↑+2H2O | |
| B. | FeBr2与少量的Cl2反应:Fe2++Cl2=Fe3++2Cl- | |
| C. | 镁与醋酸反应 Mg+2H+=Mg2++H2↑ | |
| D. | NaHCO3与NaOH反应:HCO3-+OH-=CO32-+H2O |
分析 A.碳酸镁在离子反应中保留化学式;
B.少量氯气只氧化亚铁离子;
C.醋酸在离子反应中保留化学式;
D.反应生成碳酸钠和水.
解答 解:A.MgCO3与盐酸反应的离子反应为MgCO3+2H+=Mg2++CO2↑+2H2O,故A错误;
B.FeBr2与少量的Cl2反应的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.镁与醋酸反应的离子反应为Mg+2CH3COOH=2CH3COO-+Mg2++H2↑,故C错误;
D.NaHCO3与NaOH反应的离子反应为HCO3-+OH-=CO32-+H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及与量有关的离子反应,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:多选题
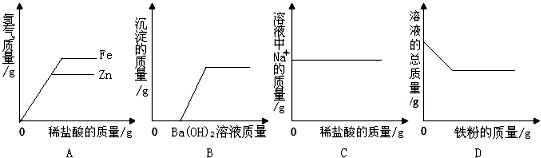
| A. | 将等质量的锌片和铁片分别加入足量的等质量等质量分数的稀盐酸中 | |
| B. | 向盐酸与硫酸钠混合溶液中加入氢氧化钡溶液 | |
| C. | 向一定量的氢氧化钠溶液中滴加稀盐酸 | |
| D. | 向一定量的硫酸铜溶液中加入铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
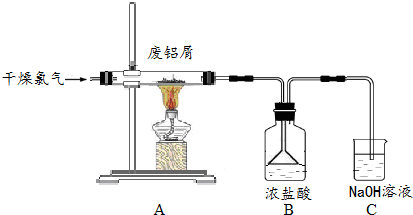
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
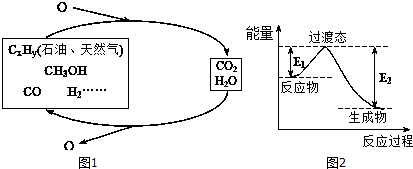
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量 | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 1/3 | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、NH4+、NO3-、OH- | B. | Ag+、K+、SO42-、Cl- | ||
| C. | H+、Na+、OH-、Cl- | D. | Ca2+、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英溶于烧碱溶液:SiO2+2OH-═SiO32-+H2O | |
| B. | 氢氧化钠溶液中通入少量的二氧化硫:SO2+OH-═HSO3- | |
| C. | 碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 溴化亚铁溶液中通入少量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上金属Mg、Cu都是用热还原法制得的 | |
| B. | 合金的性质与其成分金属的性质不完全相同 | |
| C. | 金属冶炼的本质是金属阳离子得到电子变成金属原子 | |
| D. | 越活泼的金属越难冶炼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Fe与足量H2O(g)反应,转移的电子数为2NA | |
| B. | 10mL pH=6的纯水中含OH-数目为10-10 NA | |
| C. | 1mol羟基中含有的电子数目为9 NA | |
| D. | 100 mL 1 mol/L 的Na2CO3溶液中含有CO32-的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com