
| A、气态氢化物的稳定性按X、Y、Z的顺序递减 |
| B、三种元素的含氧酸酸性H4ZO4>H3YO4>H2XO4 |
| C、元素的最高正价按X、Y、Z的顺序递减 |
| D、元素原子的半径按X、Y、Z的顺序递减 |


科目:高中化学 来源: 题型:
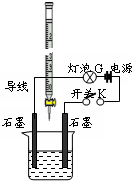 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.查看答案和解析>>
科目:高中化学 来源: 题型:
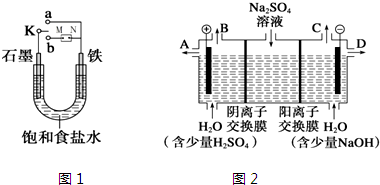
查看答案和解析>>
科目:高中化学 来源: 题型:
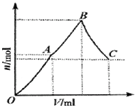 向100mL 3mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol?L-1 Ba(OH)2溶液.
向100mL 3mol?L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴加入1mol?L-1 Ba(OH)2溶液.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、Na+、SO42-、H+ |
| B、Cu2+、SO42-、H+、Cl- |
| C、K+、OH-、NO3-、HCO3- |
| D、Al3+、NO3-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
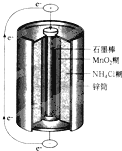 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:
最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如图所示.尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解.一般认为,放电时,电池中的反应如下:| A、E极是电池的正极,发生的是氧化反应 |
| B、只有自发的氧化还原反应才可能设计成原电池 |
| C、从结构上分析,锌锰电池应属于二次电池 |
| D、锌锰干电池工作一段时间后石墨棒变细 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石的分解反应 |
| B、铝与稀盐酸反应 |
| C、Ba(OH)2?8H2O 与NH4Cl反应 |
| D、NaOH与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
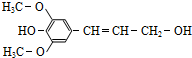 木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A、芥子醇只含有两种官能团 |
| B、芥子醇和苯酚能与溴水发生同样的取代反应 |
| C、芥子醇能与FeCl3溶液发生显色反应 |
| D、芥子醇还能发生的反应类型有氧化、加成、加聚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com