
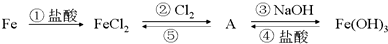
分析 该反应的流程为①铁和盐酸反应生成氯化亚铁和氢气,②氯化亚铁和氯气反应生成氯化铁,⑤氯化铁和铁反应生成氯化亚铁,③氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,④氢氧化铁和盐酸反应生成氯化铁和水,
(1)氯气具有强氧化性,氯化亚铁中+2价的铁易被氧化成氯化铁;
(2)根据①反应铁和盐酸反应Fe+2HCl=FeCl2+H2↑书写离子方程式;
(3)如果FeCl2溶液变质,变质后的物质是FeCl3,所以证明某FeCl2溶液中是否变质方法为:向溶液中加入KSCN溶液,观察现象,若溶液变红色,说明FeCl2已变质,若没有变成红色,证明FeCl2没有变质.
解答 解:该反应的流程为①铁和盐酸反应Fe+2HCl=FeCl2+H2↑,生成氯化亚铁和氢气,②氯化亚铁和氯气反应生成氯化铁,2FeCl2+Cl2=2FeCl3;⑤氯化铁和铁反应生成氯化亚铁,2FeCl3+Fe=3FeCl2;③氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,FeCl3+3NaOH=Fe(OH)3↓+3NaCl;④氢氧化铁和盐酸反应生成氯化铁和水,2Fe(OH)3+6HCl=2FeCl3+3H2O;
(1)氯化亚铁与氯气反应生成氯化铁,反应的化学方程式为:2FeCl2+Cl2=2FeCl3,
故答案为:FeCl3;
(2)铁与盐酸反应生成氯化亚铁,反应方程式为:Fe+2HCl=FeCl2+H2↑,铁单质写化学式,盐酸、氯化亚铁属于强电解质拆写,所以离子反应为:Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
(3)A.FeCl2 和NaOH溶液生成灰绿色沉淀氢氧化亚铁,氢氧化亚铁不稳定,能迅速被氧化成红褐色沉淀氧氢化铁,所以不能检验是否变质,故A错误;
B.如果氯化亚铁变质,则生成氯化铁,少量氯化铁和铁片反应但现象不明显,铁片与氯化亚铁不反应,故B错误;
C.如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故C正确;
D.无论氯化亚铁是否变质,都是强酸弱碱盐,溶液都呈酸性,所以无法检验,故D错误;
故选C.
点评 本题考查铁及其化合物性质,熟悉铁及其化合物之间的相互转化是解答关键,题目难度不大,注意检验Fe3+的物质有:KSCN(溶液变血红色)、苯酚(溶液呈紫色).


科目:高中化学 来源: 题型:选择题
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| C. | 乙醇、乙酸均能与钠反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:O<S<Na | |
| B. | 碱性强弱:LiOH>KOH>CsOH | |
| C. | 还原性:HCl>HBr>HI | |
| D. | 热稳定性:H2O<NH3<SiH4的依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 测定时刻/s | t1 | t2 | t3 | t4 |
| c(A)/(mol•L-1) | 6 | 3 | 2 | 2 |
| c(B)/(mol•L-1) | 5 | 3.5 | 3 | 3 |
| c(C)/(mol•L-1) | 1 | 2.5 | 3 | 3 |
| A. | 在t3时刻反应已经停止 | |
| B. | A的转化率比B的转化率高 | |
| C. | t1至t2时刻该反应的速率为3mol•L-1•s-1 | |
| D. | 该反应的化学方程式为2A(g)+B(g)?C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
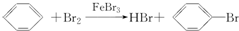
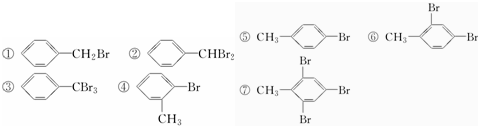
| A. | 只有①②③ | B. | 只有④⑤⑥⑦ | C. | 只有①⑤ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | |
| B. | 稀氨水中加入氢氧化化钠固体少量,由于氨水的电离平衡逆向移动,所以溶液的碱性减弱 | |
| C. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| D. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}COO)}$ 的值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com