
分析 结合m=nM、n=cV及Mg2++2OH-=Mg(OH)2↓计算.
解答 解:0.5L这种泉水作为样品,经测定该样品中含有0.48g的Mg2+,n=$\frac{0.48g}{24g/mol}$=0.2mol,Mg2+的物质的量的浓度是$\frac{0.2mol}{0.5L}$=0.4mol/L;
由Mg2++2OH-=Mg(OH)2↓可知,使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是$\frac{0.2mol×2}{1mol/L}$=0.4L,
答:Mg2+的物质的量的浓度是0.4mol/L;加入1mol/L NaOH溶液的体积是0.4L.
点评 本题考查化学反应的计算,为高频考点,把握浓度及化学反应方程式的计算为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | 将废弃物切成碎片,混在垃圾中填埋于土壤中 | |
| B. | 将废弃物焚烧 | |
| C. | 将废弃物加工成防水涂料或汽油,以节约资源 | |
| D. | 将废弃物倾倒在海洋中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是高级脂肪酸和甘油生成的酯 | |
| B. | 米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质 | |
| C. | 油脂、乙醇是人体必需的营养物质 | |
| D. | 水果因含有酯类物质而具有香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)≈10-9 mol/L | B. | pH=9 | C. | pH≈7 | D. | c(OH-)≈10-5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2 和10g O2 | B. | 5.6L N2(标准状况)和11g CO2 | ||
| C. | 9g H2O 和0.5mol Br2D | D. | 224mLH2 (标准状况)和0.01mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是熵减反应 | B. | 是熵增效应大于能量效应 | ||
| C. | 是吸热反应 | D. | 是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 银盐 性质 | AgCl | AgBr | Ag2CrO4 |
| 颜色 | 白 | 浅黄 | 砖红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制NaOH标准液时,所用的NaOH固体中含有少量的KOH杂质 | |
| B. | 滴定前对碱式滴定管仰视读数,滴定后又俯视 | |
| C. | 滴定前,碱式滴定管尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 碱式滴定管用蒸馏水洗净后,直接装入标准NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
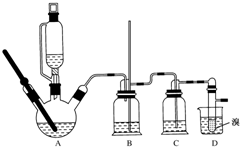 用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com