
| 元素 | A | B | C | D |
| 相关的原子结构与性质 | 元素符号为At,与稀有气体元素相邻,但半径比I大 | 其在周期表的周期数和族序数比K的均大1 | 元素符号为Tl,名称是铊,原子核外有六个电子层,与Al同主族 | 可形成双原子分子,分子内有叁键 |
| A. | 元素A的单质可能是一种有色的固体物质,其氢化物HAt易溶于水,很稳定 | |
| B. | 常温下B的单质能与冷水发生剧烈反应,其硫酸盐可能易溶于水 | |
| C. | 铊氧化物化学式为Tl2O3,是离子化合物,Tl2O3和Tl(OH)3均是两性的物质 | |
| D. | 元素D的一些氧化物在大气中会产生光化学烟雾,还会破坏臭氧层 |
分析 A.卤族元素从上到下,单质的颜色逐渐加深,氢化物稳定性减弱;
B.B在周期表的周期数和族序数比K的均大1,则为第五周期第ⅡA族元素,根据递变性规律分析;
C、铊为较活泼金属,Tl2O3和Tl(OH)3均不属于两性物质;
D、D为N,氮的部分氧化物会产生光化学烟雾,还会破坏臭氧层.
解答 解:A.卤族元素从上到下,单质的颜色逐渐加深,由于碘单质为紫黑色固体,故At的单质为有色固体,同主族从上到下氢化物稳定性减弱,HAt,很不稳定,故A错误;
B.B在周期表的周期数和族序数比K的均大1,则为第五周期第ⅡA族元素,由于硫酸钙为微溶,从上到下溶解度减小,故B对于的硫酸盐在水中不会是易溶,故B错误;
C、铊为较活泼金属,Tl2O3和Tl(OH)3均不属于两性物质,Tl(OH)3为强碱,故C错误;
D、D为N,氮的部分氧化物会产生光化学烟雾,还会破坏臭氧层,故D正确;
故选D.
点评 本题考查元素周期表与元素周期律,推断元素是解题的关键,注意理解同主族元素相似性与递变性规律,难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | CH4和C3H8 | B. | C2H4和C2H6 | C. | CH4和C3H4 | D. | C2H4和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应物的总能量低于生成物的总能量时,该反应一定不能发生 | |
| B. | 强酸跟强碱反应放出的热量一定是中和热 | |
| C. | 由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A<B<C<D<E | |
| B. | D单质能够溶解于C的最高价氧化物对应的水化物 | |
| C. | 金属性:D>C | |
| D. | 化合物AE与CE含有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
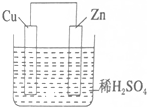 如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )
如图是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是( )| A. | ①②③⑦ | B. | ②③④⑧ | C. | ③④⑤⑧ | D. | ④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com