
| A. | 在含有大量 Al3+的无色溶液中:Cu2+、Na+、Cl-、SO 42- | |
| B. | 在含有大量 H+的 溶液中:Na+、K+、CO 32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO2- |
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:实验题
| 实验 | pH | 现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
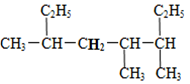
| A. | 4,5-二甲基-2-乙基庚烷 | B. | 3,4-二甲基-6-乙基庚烷 | ||
| C. | 4-甲基-2,5-二乙基己烷 | D. | 3,4,6-三甲基辛烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
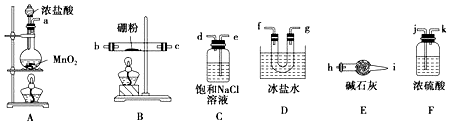
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过滤的方法分离氢氧化铁胶体和氯化铁溶液 | |
| B. | 用汽油萃取溴水中的溴 | |
| C. | 用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钾 | |
| D. | 用分液可分离乙酸乙酯和乙醇混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷酸与烧碱、硝酸与澄淸石灰水 | |
| B. | 氯化钡与硫酸钠、硫酸与硝酸钡 | |
| C. | 碳酸铵与氢氧化钠、碳酸铵与石灰乳 | |
| D. | 纯碱与硫酸、碳酸氢钾与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
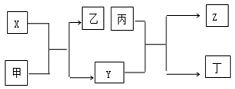 由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )
由短周期主族元素X、Y、Z组成的单质(化学式也分别为X、Y、Z),X为金属,其核外电子数为Y原子序数的2倍,Y的最低负化合价与Z的最高正化合价的数值相等,甲、乙、丙、丁四种均为氧化物,甲和丁为无色的气体,固体甲可用于人工降雨,乙和丙熔点均很高,且它们在一定条件下能发生如下反应,下列说法中正确的是( )| A. | X为第三周期II族元素,Y和Z位于同一主族 | |
| B. | 甲、乙、丙均能与水发生化合反应 | |
| C. | 工业上常用电解乙制备X | |
| D. | X可用于制焰火烟花,Z可用作太阳能电池的材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
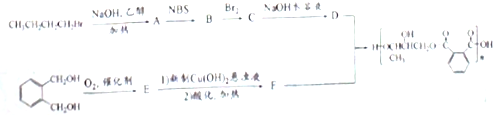

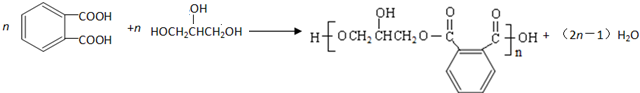
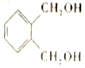 的符合下列条件的同分异构体有6 种(不考虑立体异构)
的符合下列条件的同分异构体有6 种(不考虑立体异构)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=2c2 | B. | c1>c2 | C. | c1=c2 | D. | c1<c2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com