
下列有关铜锌原电池(下图)的叙述正确的是
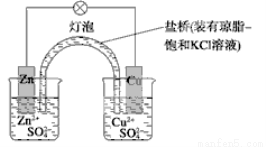
A.正极反应为Zn-2e-===Zn2+ B.取下盐桥,原电池仍可工作
C.在外电路中,电子从正极流向负极 D.电池反应为Zn+Cu2+===Zn2++Cu
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 标准状况下,2.24L苯中含0.6NA个氢原子
B. 22.4LCl2通入水中充分反应,共转移NA个电子
C. 1L1mol·L-1氯化铜溶液中Cu2+的数目小于NA
D. 0.1mol铁在0.1molCl2中充分燃烧,转移的电子数为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
D.0.1mol·L-1的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列叙述I和II均正确并且有因果关系的是
| 叙述I | 叙述II |
A | NaHCO3能与碱反应 | 食品工业用NaHCO3作焙制糕点的膨松剂 |
B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
C | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | K2FeO4可用于净化自来水并杀菌消毒 |
D | HClO具有弱酸性 | HClO可作漂白剂 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质
B.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
C.煤油可由石油分馏获得,可用于保存少量金属钠
D.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列化学应用中不涉及氧化还原反应的是
A.工业上由硅的氧化物制备硅单质
B.生活中使用明矾净水,除去水中的悬浮的微小颗粒
C.漂白粉用作疫区的环境消毒
D.过氧化钠用作呼吸面具的供氧剂
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:填空题
(12分)烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
(1)烟气脱硫、脱硝的环境意义是 ;
(2)一种选择性催化脱硝(NO2)的原理为:6NO2+8NH3  7N2+12H2O
7N2+12H2O
①上述反应中被还原的元素是 (填元素符号),反应中每转移2.4mol电子,生成N2的物质的量为 。
②超音速飞机排放的尾气是平流层中NOx的主要来源.它们破坏臭氧层的主要机理为:
Ⅰ、O3 O+O2
O+O2
Ⅱ、NO+O3 →NO2+O2
Ⅲ、 NO2+O→NO+O2
上述反应中NO所起的作用是 ;
(3)下表列出了2种燃煤烟气脱硫方法的原理。
方法Ⅰ | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
方法Ⅰ中用氨水吸收燃煤烟气中的SO2转化为NH4HSO3,写出该反应的离子方程式: ,是利用了SO2的 性质(选填字母编号)。
A.漂白性 B.氧化性 C.还原性 D.酸性氧化物
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(11分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
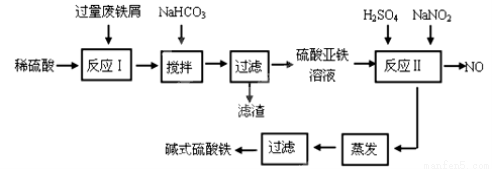
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1) 加入少量NaHCO3的目的是调节pH在 范围内,使溶液中的 沉淀(写离子符号)。
(2)反应Ⅱ中的离子方程式为 。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为3.6g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com