
| A. | 该物质为离子晶体 | |
| B. | 该物质可用通过C60吸附N2而制得 | |
| C. | C(N3)4中碳元素为正价 | |
| D. | 18g该物质完全分解可以产生13.44升(标准状况)氮气 |
分析 A.根据物质C(N3)4的微粒构成来确定所述的晶体类型;
B.C60吸附N2的过程是物理变化;
C.根据C、N得电子能力来确定价态的正负情况;
D.根据化学方程式结合Vm=22.4L/mol的使用条件进行计算.
解答 解:A.该物质由非金属元素构成,没有阴阳离子,故不为离子晶体,故A错误;
B.C和N之间存在共价键,不能是吸附作用的结果,故B错误;
C.C、N得电子能力:C<N,所以C显示正价,N显示负价,故C正确;
D.根据化学方程式,18g即0.1mol该物质完全分解可以产生0.6mol即标况下13.44升氮气,故D正确.
故选AB.
点评 本题考查较为综合,涉及晶体类型、氧化还原反应的判断、原子结构的判断,题目难度不大,把握氧化还原反应的规律,准确判断元素的化合价是解题关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 该溶液中一定不含K+、NH4+、A13+、SiO32- | |
| B. | 该溶液中一定含有A13+、CO32-、Cl- | |
| C. | 该溶液中可能含有Cl- | |
| D. | 该溶液中一定含有K+、AlO2-、CO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
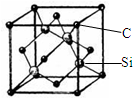 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
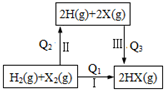
| A. | Q3>0 | B. | Q1=Q2+Q3 | ||
| C. | 按Cl、Br、I的顺序,Q2依次增大 | D. | Q1越大,HX越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com