
| A、78g苯含有碳碳双键的数目为3NA |
| B、常温常压下,22.4L二氧化碳含有的原子总数为3NA |
| C、1mol Fe与足量稀HNO3反应,转移3NA个电子 |
| D、1L 1mol?L-1的NaClO溶液中含有ClO-的数目为NA |


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、Y形成的化合物中可能含有双键 |
| B、X单质和Z单质在暗处能剧烈反应 |
C、W元素与Z元素形成的化合物用电子式表示形成过程为: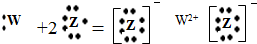 |
| D、XZ的沸点在与Z同族的其它X的化合物中最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| B、向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则溶液中含有SO42ˉ |
| C、向某溶液中滴加少量氯水,再滴加KSCN溶液,若溶液变成血红色,则原溶液中一定有Fe2+ |
| D、向某黄色溶液中加入淀粉溶液,若溶液变蓝色,则原溶液中含有I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验Ⅰ量取20.0mL的H2SO4待测液放入锥形瓶中 |
B、 实验Ⅱ用CaC2和饱和食盐水反应制取C2H2 |
C、 实验Ⅲ制取氨气 |
D、 实验Ⅳ褪色证明了乙烯可以与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
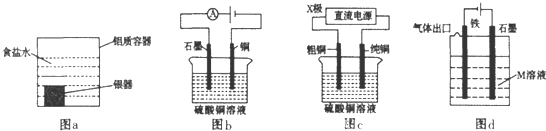
| A、利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e-=2Ag+S2- |
| B、图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出 |
| C、图c中的X极若为负极,则该装置可实现粗铜的精炼 |
| D、图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL蒸馏水 |
| B、100mL 0.2mol?L-1 AgNO3 |
| C、100 mL 0.1mol?L-1 AlCl3 |
| D、100mL 0.1 mol?L-1盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com