
如图所示, 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路(未闭合K)后发现
为电镀槽。接通电路(未闭合K)后发现 上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
上的c点显红色。为实现铁片上镀铜,接通K后,使c、d两点短路。下列叙述不正确的是( )
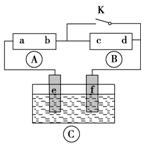
A.b为直流电源的负极
B.f极为阴极,发生还原反应
C.e极材料为铁片,f极材料的铜片
D.可选用CuSO4溶液或CuCl2溶液作电镀液
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
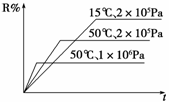
密闭容器中进行下列反应:M(g)+N(g) R(g)+2 L,
R(g)+2 L,
如图所示R%是R的体积分数,t是时间,下列关于该反应的分析正确的是( )
A.正反应吸热,L为气体 B.正反应吸热,L为固体或纯液体
C.正反应放热,L为气体 D.正反应放热,L为固体或纯液体
查看答案和解析>>
科目:高中化学 来源: 题型:
在绝热、恒容的密闭容器中进行反应2NOg)+2COg)2CO2g)+N2g),下列示意图正确且能高效能反应在进行到t1时刻平衡状态的是双选) )。
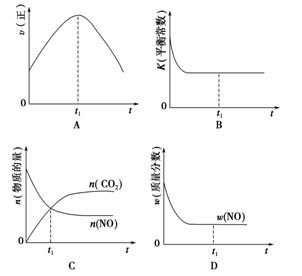
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是
A.KHC2O4溶液呈弱碱性
B.B点时:c(K+)>c(HC2O4-)> c(C2O42-)>c(H+)>c(OH-)
C.C点时:c(K+)>c(HC2O4-)+c(C2O42-)+c(H2C2O4)
D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: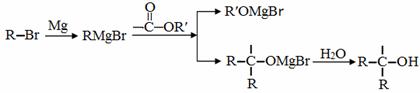
A是一种重要的化工原料,能使溴水反应褪色,且分子内所有的原子都在一条直线上,在不同的条件下,A可以转化为烃B和烃C,B和C的核磁共振氢谱中都只有一个吸收峰,B能使溴水反应褪色而C不能使溴水反应褪色。A~J分别代表一种有机物,并有如下的转化关系:
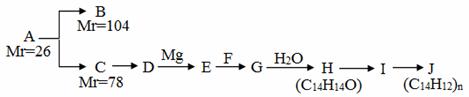
回答下列问题:
(1)A的结构简式为________________;
(2)B的结构简式为_________________;
(3)反应C→D所需要的试剂是_________________________;
(4)H不能发生催化氧化,H的结构简式是____________________________________;
(5) I中的官能团名称是___________________;
(6) I中可能含有的杂质是_____________________(写结构简式);
(7)写出I→J的反应方程式________________________________________________;
(8)H有多种同分异构体,符合下列条件的同分异构体有________种。
①能与FeCl3溶液显紫色;②有二联苯结构;③二联苯上有两个侧链。
其中核磁共振氢谱中吸收峰最少的结构简式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示[已知:2SO2(g)+O2(g)2SO3(g) ΔH=-196.6 kJ·mol-1]:
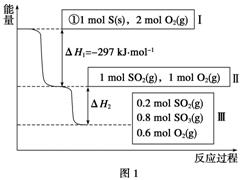
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:__________________。
(2)ΔH2=____________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比|ΔH2|________(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为________,若溶液中发生了氧化还原反应,则该过程的离子方程式为____________。
(5)恒容条件下,下列措施中能使2SO2(g)+O2(g)2SO3(g)中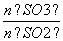 增大的有________。
增大的有________。
A.升高温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g)
D.使用催化剂
(6)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t4时引起平衡移动的条件可能是__________;图中表示平衡混合物中SO3的含量最高的一段时间是____________。
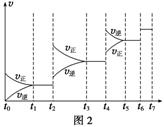
(7)各阶段平衡时对应的平衡常数如下表所示:
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
K1、K2、K3、K4之间的关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和应用均正确的是( )
A.NH3能氧化氮氧化物,可用于汽车尾气净化
B.瓷坩埚能耐高温,可用于加热分解石灰石
C.Fe在O2中的燃烧产物可用于制红色涂料
D.Mg(OH)2分解吸热且生成高熔点固体,可用作阻燃剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于原子半径和第一电离能的变化趋势的叙述中,正确的是
A.同周期元素的原子半径随着核电荷数的增大而增大
B.同主族元素的原子半径随着核电荷数的增大而增大
C.同周期元素的第一电离能随着核电荷数的增大而增大
D.同主族元素的第一电离能随着核电荷数的增大而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4三种溶液中,测得c(NH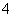 )分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
)分别为a、b、c(单位为mol/L),下列判断正确的是 ( )
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com