
| A. | 90 g丙醇中存在的共价键总数为15 NA | |
| B. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol O2转移的电子数为0.2 NA | |
| D. | 2 L 0.5 mol/L亚硫酸溶液中含有的H+离子数为2 NA |
分析 A、求出丙醇的物质的量,然后根据1mol丙醇中含11mol共价键来分析;
B、羟基不显电性,而氢氧根带负电;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价;
D、亚硫酸为弱酸,不能完全电离.
解答 解:A、90g丙醇的物质的量为1.5mol,而1mol丙醇中含11mol共价键,故1.5mol丙醇中含16.5mol共价键即16.5NA个,故A错误;
B、羟基不显电性,而氢氧根带负电,故1mol羟基中含9NA个电子,而1mol氢氧根中含10NA个电子,故B错误;
C、过氧化钠与水反应时,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时转移0.2NA个电子,故C正确;
D、亚硫酸为弱酸,不能完全电离,故溶液中的氢离子的个数小于2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
 ,写出CO2的电子式
,写出CO2的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “蜡炬成灰泪始干”既包含物理变化又包含化学变化 | |
| B. | Al2O3熔点高,可用于制作耐高温仪器 | |
| C. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油(主要成分是脂肪烃) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
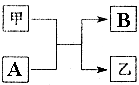 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 长期饮用纯净水,有可能引起一些微量元素缺乏症 | |
| B. | 明矾既能沉降水中的悬浮物,又能杀菌消毒 | |
| C. | 合成洗涤剂和纯碱溶液都可洗去油污,二者去污原理相同 | |
| D. | 纤维素被食用进入人体内,在酶的作用下最终水解为葡萄糖为人体提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
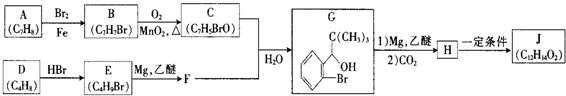
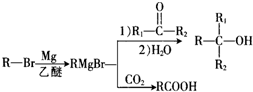
 .
. +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$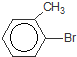 +HBr,反应类型为取代反应.
+HBr,反应类型为取代反应.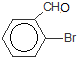 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
. 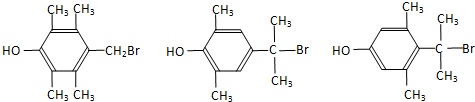 任意2种.
任意2种.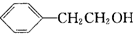
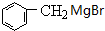 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用金属钠可鉴别乙醇和乙醚 | |
| B. | 用新制的银氨溶液可鉴别甲酸乙酯和丙醛 | |
| C. | 用水可鉴别苯和溴苯 | |
| D. | 用酸性高锰酸钾溶液可鉴别己烷和3-己烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
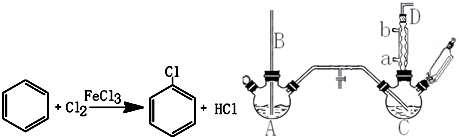
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com