
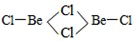
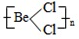
分析 Ⅰ. BeCl2中Be原子成2个Be-Cl,铍具有空轨道,氯具有孤电子对,据此分析二聚体(BeCl2)2、多聚体(BeCl2)N的结构简图;根据价层电子对互斥理论判断原子杂化类型;
Ⅱ.(1)核电荷数=原子序数,由原子序数可知电子排布,或由电子排布确定原子序数,电子排布中电子层数=周期数、最外层电子数=组序数,由价电子可知元素的分区,以此来解答;
(2)单电子数最多,说明该原子的核外电子排布式中未成对电子数最多,根据原子核外电子排布式分析解答;
(3)Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;
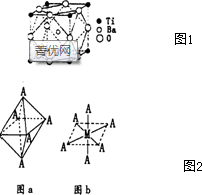
(4)①由晶胞的结构可知,根据均摊法可以进行计算出晶胞中含有各种原子的个数,进而确定化学式;
②根据各类晶体的性质判断晶体类型,分子晶体的熔沸点较低;
③Ti2+位于正八面体的中心,NH3和Cl-位于正八面体顶点,利用空间想象能力分析;
解答 解:Ⅰ.BeCl2中Be原子成2个Be-Cl,单体BeCl2 结构简图为Cl-Be-Cl,Be原子的杂化轨道数为2,故Be原子采取sp杂化方式,二聚体为氯的孤电子对提供给铍,所以(BeCl2)2 结构简图为 ,杂化轨道数为3,所以碳原子采取sp2杂化; 铍具有空轨道,氯具有孤电子对,所以多聚体(BeCl2)N结构简图为
,杂化轨道数为3,所以碳原子采取sp2杂化; 铍具有空轨道,氯具有孤电子对,所以多聚体(BeCl2)N结构简图为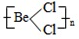 中价层电子对个数=4,中心原子是以sp3杂化;
中价层电子对个数=4,中心原子是以sp3杂化;
故答案为:Cl-Be-Cl;sp杂化;  ;Sp2杂化;
;Sp2杂化;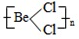 ; Sp3杂化;
; Sp3杂化;
Ⅱ.(1)Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,位于第四周期第ⅣB族,最后填充d电子,为d区元素,
Cr的原子序数为24,电子排布为1s22s22p63s23p63d54s1,位于第四周期第ⅥB族,最后填充d电子,为d区元素,
Fe的电子排布式为1s22s22p63s23p63d64s2,位于第四周期第ⅥⅡ族,最后填充d电子,为d区元素,
故答案为:d;四;
(2)Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,未成对电子数是2;
24Cr元素为24号元素,其核外电子排布式为:1s22s22p63s23p63d54s1,未成对电子数是6;
Fe的电子排布式为1s22s22p63s23p63d64s2,未成对电子数为4;所以原子结构中单电子数最多的元素为铬,
故答案为:铬;
(3)Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,则M层电子排布式为:3s23p63d5,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,
故答案为:3s23p63d5;5;
(4)①由晶胞结构示意图可知,Ba在立方体的中心,完全属于该晶胞;Ti处于立方体的8个顶点,每个Ti有$\frac{1}{8}$属于该晶胞;O处于立方体的12条棱的中点,每个O有$\frac{1}{4}$属于该晶胞.即晶体中N(Ba):N(Ti):N(O)=1:(8×$\frac{1}{8}$):(12×$\frac{1}{4}$)=1:1:3,所以化学式为:BaTiO3,
在晶胞中与钛离子距离最近的是氧原子,分布在与钛相连的棱边的中点上,而与一个钛相连的边有六个,所以钛的配位数为6,
故答案为:BaTiO3; 6;
②常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,熔沸点较低,晶体由分子形成,属于分子晶体;
故答案为:分子;
③Ti2+位于正八面体的中心,NH3和Cl-位于正八面体顶点,当两个Cl-相邻时为一种结构,两个Cl-不相邻时为另一种结构,即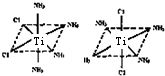 ,共有两种结构,
,共有两种结构,
故答案为:2.
点评 本题考查较为全面,涉及到电子排布式、分子空间构型、杂化类型的判断、晶体类型、以及配合物结构,注意把握原子的电子排布与元素的位置关系,Cr的电子排布书写为解答的易错点,注意半满为稳定状态,题目难度中等.


科目:高中化学 来源:2017届黑龙江省哈尔滨市高三上学期期中考试化学试卷(解析版) 题型:选择题
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如下图所示。下列判断正确的是
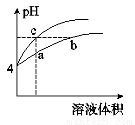
A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液中水的电离程度:a>b>c
C.b点溶液中:c(H+)+c(NH3·H2O)=c(OH-)
D.用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体
积Vb=Vc
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
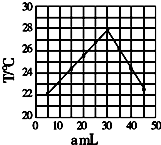 将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )
将amL 0.1mol/LHCl溶液和bmL未知浓度的NaOH溶液混合均匀后,测量并记录溶液温度,实验结果如图(实验中始终保持a+b=50ml).下列叙述正确的是( )| A. | 做该实验时,环境温度为22摄氏度 | |
| B. | 该实验表明化学能可能转化为热能 | |
| C. | NaOH溶液的浓度约为0.1mol/L | |
| D. | 该实验表明有水生成的反应都是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
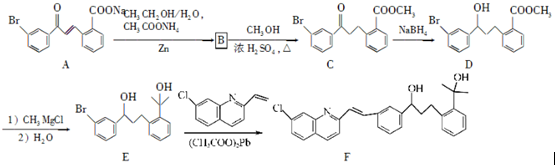 请回答下列问题:
请回答下列问题: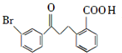 .
.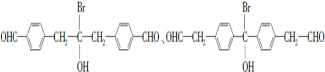 .
. 为原料制备
为原料制备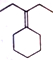 的合成路线流程图(乙醚溶剂及无机试剂任用)
的合成路线流程图(乙醚溶剂及无机试剂任用)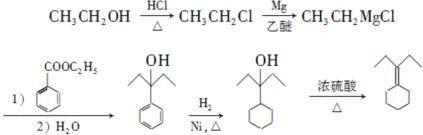 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
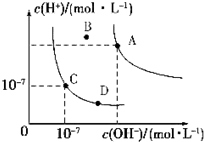
| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3是氧化剂 | |
| B. | 被氧化与被还原的氯元素的质量比为5:1 | |
| C. | Cl2既是氧化产物又是还原产物 | |
| D. | 0.1mol KClO3 参加反应时有1mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 K和40 Ca原子中的质子数和中子数都相等 | |
| B. | 某元素最外层只有一个电子,则它一定是ⅠA族元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | R |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | Z的氧化物与X单质在任何条件下都不会发生置换反应 | |
| D. | R的最外层电子数一定为5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+m}$(A-N+m) | B. | $\frac{a}{A}$(A-N) | C. | $\frac{a}{A+m}$(A-N) | D. | $\frac{a}{A}$(A-N+m) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com