
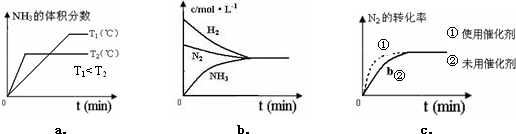
分析 (1)a.升高温度可以增大活化分子百分数,导致加快反应速率;
b.增大压强不能增大活化分子百分数,但增大单位体积内活化分子个数,所以可以加快反应速率;
c.使用催化剂可以降低活化能,加快反应速率;
d.反应物接触面积越大,其反应速率越快;
(2)①化学平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$;
②该反应的正反应是放热反应,升高温度平衡逆向移动,平衡常数减小;
(3)N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,$\frac{2x}{1-x+3-3x+2x}$×100%=20%,
解得x=$\frac{1}{3}$,根据K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$进行计算;
(4)a.升高温度,平衡逆向移动,则氨气的体积分数减小;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动.
解答 解:(1)a.升高温度可以增大活化分子百分数,有效碰撞的次数增加,则加快反应速率,故a正确;
b.增大压强,可增大单位体积活化分子数目,则加快反应速率,故b错误;
c.使用催化剂,降低反应的活化能,加快反应速率,但反应物分子平均能量不变,故c错误;
d.增大固体表面积,可增大反应速率,故d正确,
故答案为:ad;
(2)①K为生成物浓度幂之积与反应物浓度幂之积的比,则K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$,故答案为:$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$;
②该反应为放热反应,升高温度,平衡逆向移动,则平衡常数K减小,温度越高,K越小,故答案为:小;
(3)N2(g)+3H2(g)?2NH3(g)
开始 1 3 0
转化 x 3x 2x
平衡1-x 3-3x 2x
平衡混合气体中氨的体积分数为20%,$\frac{2x}{1-x+3-3x+2x}$×100%=20%,
解得x=$\frac{1}{3}$,K=$\frac{{c}^{2}(N{H}_{3})}{{c}^{3}({H}_{2}).c({N}_{2})}$=$\frac{(\frac{2}{3})^{2}}{\frac{2}{3}×{2}^{3}}$=$\frac{1}{12}$,
故答案为:$\frac{1}{12}$;
(4)a.升高温度,平衡逆向移动,则氨气的体积分数减小,但反应到达平衡的时间缩短,故正确;
b.反应到达平衡时,各物质浓度变化量之比等于其计量数之比,氢气与氨气浓度变化量之比为3:2,故错误;
c.使用催化剂加快反应速率,缩短反应时间,但不影响平衡移动,符合题意,故正确;
故选ac.
点评 本题考查较综合,涉及化学平衡及常数的有关计算、平衡及反应速率影响因素等知识点,侧重考查学生分析判断及计算能力,这些都是高频考点,注意催化剂只影响反应速率不影响平衡移动,题目难度中等.


科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
下列水解的离子方程式正确的是( )
A.S2-+2H2O H2S+2OH-
H2S+2OH-
B.AlO2一+2H2O Al(OH)3+OH-
Al(OH)3+OH-
C.CO32-+H2O=HCO3-+OH-
D.Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源:2017届吉林省长春市高三上学期期中考试化学试卷(解析版) 题型:选择题
已知:Kw=1.0×10-14,Al(OH)3 AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
AlO2-+H++H2O,K=2.0×10-13。则Al(OH)3溶于NaOH溶液反应的平衡常数数值为
A.10
B.15
C.20
D.25
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:推断题
(1)某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解).回答下列问题:
①溶液中存在的离子是;
②写出溶液中加入过量的稀硫酸反应的离子方程式.
(2)CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等,写出CNO-在酸性条件下被NaClO氧化的离子方程式:________。
(3)酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式________________。
②取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲是亚硫酸氢钠粉末投入稀硝酸溶液中的有关图象 | |
| B. | 乙是等pH的MCl2和NCl2溶液稀释时pH变化图象,由此可推测M的金属性较强 | |
| C. | 由丙可知,双氧水在有催化剂存在时的热化学方程式为2H2O2(l)═2H2O(l)+O2(g)△H=-2(Ea2′-Ea2) kJ•mol-1 | |
| D. | 丁是向硝酸银溶液中滴加氨水时,沉淀质量与氨的物质的量的关系图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
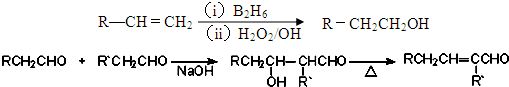
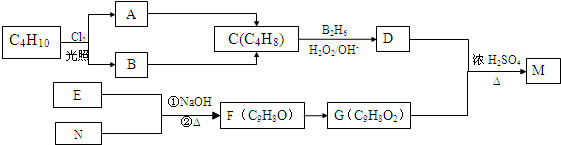
 、
、 ;
;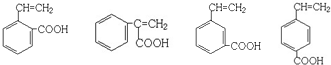 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇汽油比普通汽油保质期长 | |
| B. | 使用乙醇汽油可减少大气雾霾 | |
| C. | 区别两者可用测沸点的方法,普通汽油沸点高 | |
| D. | 区别两者可加入水中,只有普通汽油能分层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2SO4溶液中滴入Ba(OH)2溶液,产生白色沉淀:Ba2++SO42-=BaSO4↓ | |
| B. | 向H2O中加入少量Na2O2,产生无色气体:2Na2O2+2H2O=O2↑+4OH-+4Na+ | |
| C. | 向Cl2水中滴入适量Fe(NO3)2 溶液,溶液变为黄色:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I-+2H+=I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 煎炸食物的花生油和牛油都是可皂化的饱和酯类 | |
| D. | 装饰材料释放的甲醛会造成污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com