
| A. | 若X、Y位于第ⅠA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | 若气态HnX的沸点高于HnY,则X、Y只能位于元素周期表的第ⅥA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
分析 A.若X、Y位于第ⅠA族,则X为H元素、Y可以为Na元素;
B.若X、Y位于第三周期,则X为Cl元素,Y可以为Na、Mg、Al、Si、P、S;
C.若气态HnX的沸点高于HnY,若X可以为N、O、F,对应的Y分别为P、S、Cl;
D.若X、Y位于周期表的同一周期,则X可以为Cl、Y可以为S等,非金属性越强,最高价含氧酸的酸性越强.
解答 A.若X、Y位于第ⅠA族,则X为H元素、Y可以为Na元素,H元素与氧元素可以组成H2O、H2O2,Na元素与氧元素可以组成Na2O、Na2O2,故A正确;
B.若X、Y位于第三周期,则X为Cl元素,Y可以为Na、Mg、Al、Si、P、S,Na等与Cl形成NaCl为离子化合物,而Al等与Cl形成共价化合物,故B正确;
C.若气态HnX的沸点高于HnY,若X可以为N、O、F,对应的Y分别为P、S、Cl,X、Y可能位于元素周期表的VA族、ⅥA族或ⅦA族,故C错误;
D.若X、Y位于周期表的同一周期,则X可以为Cl、Y可以为S等,非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故D正确,
故选:C.
点评 本题考查结构性质位置关系应用,需要学生熟练掌握短周期元素,难度中等.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①② | C. | ①③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
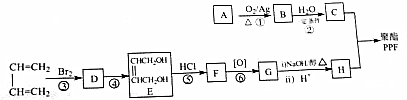

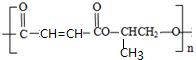 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使酚酞变红的溶液:Na+、NH4+、SO42-、NO3- | |
| C. | 0.1mol•L-1AgNO3溶液:H+、K+、SO42-、Cl- | |
| D. | 使石蕊变红色的溶液:Mg2+、K+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜片上出现铜绿[Cu2(OH)2CO3] | B. | 铁制菜刀生锈 | ||
| C. | 铝锅表面生成致密的氧化膜 | D. | 用醋清理水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.
化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z可以组成一种Y和Z的质量比为7:8的化合物 | |
| B. | X、Y、Z组成的盐中既含离子键又含共价键 | |
| C. | X和Z可以组成原子个数比分别为1:1和2:1,常温下为液态的两种化合物 | |
| D. | 由X、Y、Z三种元素中的任意两种组成的具有10电子的微粒仅有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com