
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | 配制氯化亚铁溶液时需加少量铁粉 | |
| D. | 将氯化铝溶液加热蒸干并灼烧,最后得到的固体是氧化铝 |
分析 A.TiCl4在加热的条件下遇水水解可得TiO2•xH2O,同时生成HCl气体,加热制备TiO2;
B.向沸水中滴加少量的FeCl3溶液,FeCl3水解生成Fe(OH)3胶体;
C.氯化亚铁空气中易氧化为氯化铁,加入少量铁粉可以和氯化铁反应生成氯化亚铁,防止氯化亚铁被氧化;
D.强酸弱碱盐水解显酸性,水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物;
解答 解:A.在加热的条件下,TiCl4水解得TiO2•xH2O和HCl,反应方程式为:TiCl4+(x+2)H2O=TiO2•xH2O↓+4HCl↑,加热制备得到TiO2,和水解有关,故A不符合;
B.向沸水中滴加少量的FeCl3溶液生成氢氧化铁胶体,反应的化学方程式为:FeCl3+3H2O $\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl,其水解方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,和水解有关,故B不符合;
C.氯化亚铁是强酸弱碱盐,空气中易氧化为氯化铁,加入少量铁粉可以和氯化铁反应生成氯化亚铁,防止氯化亚铁被氧化,和水解无关,故C符合;
D.AlCl3属于强酸弱碱盐水解显酸性,其水解离子方程式表示为:Al3++3H2O?Al(OH)3+3H+,氯化铝水溶液在加热时水解生成Al(OH)3和HCl,HCl易挥发,灼烧得到Al2O3,和水解有关,故D不符合;
故选C.
点评 本题考查了盐类水解原理分析应用,主要是水解产物的理解应用,题目难度中等.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:选择题
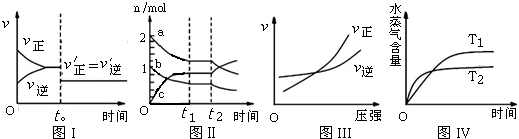
| A. | 图I:反应H2+I2═2HI 达平衡后,t0时降低温度反应速率随时间的变化 | |
| B. | 图Ⅱ:反应2SO3═2SO2+O2 达平衡后,扩大容器体积时各成分的物质的量随时间的变化(图中a、b、c分别代表SO2、O2、SO3的物质的量的变化曲线) | |
| C. | 图III:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 | |
| D. | 图IV:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
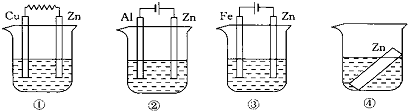
| A. | ①②③④ | B. | ②①③④ | C. | ③①④② | D. | ②①④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-) | |
| B. | 溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=0.1mol/L | |
| C. | 溶液①、③等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+) | |
| D. | 溶液①、③等体积混合,混合液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
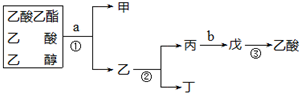
| A. | 甲是乙酸乙酯 | |
| B. | ①、②操作都是蒸馏 | |
| C. | a试剂是饱和Na2CO3溶液 | |
| D. | 制备乙酸乙酯时加试剂的顺序是:乙醇、浓硫酸、乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②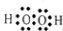 ③
③ ④
④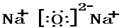 ⑤
⑤ ⑥
⑥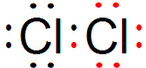 ⑦
⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com