
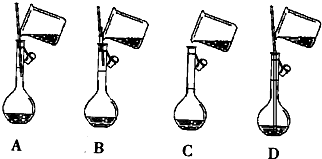
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变规律计算需要浓硫酸体积;
(2)配制一定物质的量浓度溶液主要仪器为容量瓶,依据配制溶液体积选择合适的容量瓶;
(3)依据配制一定物质的量浓度溶液一般步骤选择需要仪器;
(4)容量瓶带有活塞,使用过程中需要上下颠倒,使用前需要检查是否漏水;
(5)移液时,应用玻璃棒引流,玻璃棒下端应靠在刻度线下容量瓶壁上,据此解答;
(6)移液后需要进行洗涤,并将洗涤液全部转移容量瓶;
(7)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)质量分数为98%、密度为1.84g•cm-3的浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V则,依据溶液稀释过程中溶质的物质的量不变得:V×18.4mol/L=1mol/L×500mL,解得V=27.2mL;
故答案为:27.2;
(2)配制500mL、1mol•L-1的硫酸溶液,需要用500mL容量瓶;
故答案为:500mL容量瓶;
(3)配制一定物质的量浓度溶液一般步骤:计算、量取、稀释、移液、洗涤、定容、摇匀、装瓶,依次用到的仪器:量筒、胶头滴管、烧杯、玻璃棒、500mL容量瓶;
故答案为:⑤⑦④②⑥;
(4)容量瓶带有活塞,使用过程中需要上下颠倒,使用前需要检查是否漏水;
故答案为:是否漏水;
(5)移液时,应用玻璃棒引流,玻璃棒下端应靠在刻度线下容量瓶壁上,符合条件的操作为A;
故答案为:A;
(6)移液后需要进行洗涤,并将洗涤液全部转移容量瓶;
故答案为:洗涤;
(7)①摇匀后发现液面低于刻度线再加水,导致溶液体积偏大,溶液浓度偏低,故选B;
②容量瓶中原有少量蒸馏水,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变,故选C;
③定容时俯视观察液面,导致溶液体积偏小,溶液浓度偏高,故选A;
故答案为:B;C;A.
点评 本题主要考查了配制一定物质的量的溶液的配制方法和注意事项,明确配制原理和操作步骤即可解答,题目难度不大,注意误差分析的方法.


科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾的一种重要因素 | |
| B. | 食品中的抗氧化剂本身是难于氧化的物质 | |
| C. | 含SO42-的澄清溶液中不会含Ba2+ | |
| D. | 凡溶于水能电离出H+离子的化合物均属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X氢化物溶于水后,在常温下,该溶液的pH<7 | |
| B. | Y的最高价氧化物的水化物具有两性 | |
| C. | Z离子在水溶液中水解导致其溶液显碱性 | |
| D. | 简单离子的半径:Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组号 | 反应温度(℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O的体积(mL) | ||||
| 体积(mL) | 浓度(mol•L-1) | 体积(mL) | 浓度(mol•L-1) | |||
| A | 10 | 5.0 | 0.10 | 10.0 | 0.10 | 5.0 |
| B | 10 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| C | 30 | 5.0 | 0.10 | 5.0 | 0.10 | 10.0 |
| D | 30 | 5.0 | 0.20 | 5.0 | 0.10 | 10.0 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )
科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.下列关于该电池叙述错误的是( )| A. | 电池工作时,是将太阳能转化为电能 | |
| B. | 铜电极为正极,电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| C. | 电池内部H+透过质子交换膜从左向右移动 | |
| D. | 为提高该人工光合系统的工作效率,可向装置中加入少量盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
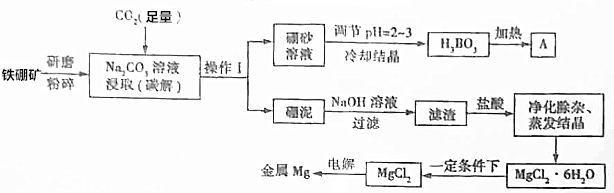
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
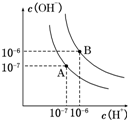 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com