
分析 (1)热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用;露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,据此分析解答;
(2)依据在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ和盖斯定律计算得到所需热化学方程式.
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,所以符合环境保护理念的是BD;
故答案为:BD;
(2)由题意可写出热化学方程式:
①C(s)+O2(g)═CO2(g)△H=-a kJ•mol-1,
②4Al(s)+3O2(g)═2Al2O3(s)△H=-4b kJ•mol-1.
高温下铝置换碳的反应为:4Al+3CO2$\frac{\underline{\;高温\;}}{\;}$2Al2O3+3C,
根据盖斯定律:②-①×3可得,4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),△H=(3a-4b)KJ/mol;
故答案为:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s),△H=(3a-4b)KJ/mol.
点评 本题考查了环境污染与防护、热化学方程式书写、焓变的计算,熟悉热化学方程式书写注意问题,明确盖斯定律计算反应热的方法是解题关键,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
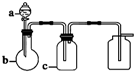 表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )| 选项 | 气体 | a | b | c |
| A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| B | CO2 | 70%浓H2SO4 | Na2SO3固体 | 95%浓H2SO4 |
| C | NO | 稀硝酸 | 铜屑 | H2O |
| D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究温度对反应速率影响时,应先分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度后再混合,不是先将两种溶液混合后再用水浴加热 | |
| B. | H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 | |
| C. | 使用含有氯化钠的融雪剂会加快铁桥梁的腐蚀 | |
| D. | 判断皂化反应是否完全,可取反应后的混合液滴入热水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量稀HNO3中加入足量铁粉:Fe+4H++NO3-═NO↑+Fe3++2H2O | |
| B. | 以石墨作电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | NH4HCO3溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.
将全部由短周期元素组成的化合物X加热分解,可得A、B、C、D、E和H2O六种产物,其中A、B、C都是中学化学中常见的氧化物,气体D是单质E所含元素的氢化物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | e电极上可以析出使湿润的淀粉KI试纸变蓝的气体 | |
| B. | c电极周围溶液变红 | |
| C. | A烧杯内溶液的pH升高 | |
| D. | B烧杯中加一定量的KCl固体可恢复原状 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与12C60的碳原子化学性质不同 | B. | 与15N含的中子数相同 | ||
| C. | 与12C60互为同素异形体 | D. | 与12C、13C互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玉米芯、甘蔗渣等在稀硫酸作用下水解所得的木糖C5H10O5,属于多羟基醛,木糖与浓硫酸加热作用可生成糠醛 ,由木糖生成糠醛的反应有消去反应 ,由木糖生成糠醛的反应有消去反应 | |
| B. | 醛类、葡萄糖、甲酸及其甲酸酯类均能发生银镜反应 | |
| C. | 阿斯巴甜是目前使用最广泛的甜味剂,其结构简式为 它既能与酸反应又能与碱反应,是一种常见的氨基酸 它既能与酸反应又能与碱反应,是一种常见的氨基酸 | |
| D. | BAD是一种紫外线吸收剂,它的结构简式如下: 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 1 mol BAD最多能和含6 mol NaOH的溶液进行反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.
某研究性学习小组拟探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液时,生成氢氧化物沉淀的过程.| 较大量存在的含金属元素的离子 | 检验方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com