
| A. | <98.32kJ | B. | >98.32kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
分析 根据热化学方程式得出生成1molSO3时放出的热量,利用极限法计算出128gSO2和32gO2反应生成SO3的物质的量,计算放出的热量,由于可逆反应的不完全性,所以放出的热量小于按极限法计算放出的热量.
解答 解:根据热化学方程式SO2(g)+$\frac{1}{2}$O2(g)  SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,则128g即$\frac{128g}{64g/mol}$=2molSO2和32g即$\frac{32g}{32g/mol}$=1molO2不能完全反应,所以放出的热量小于196.64kJ.
SO3(g)△H=-98.32kJ/mol的含义,可知SO2和O2反应生成1molSO3时放出的热量为98.32kJ,所以生成2molSO3时放出的热量为196.64kJ,由于是可逆反应,则128g即$\frac{128g}{64g/mol}$=2molSO2和32g即$\frac{32g}{32g/mol}$=1molO2不能完全反应,所以放出的热量小于196.64kJ.
故选C.
点评 本题以反应热的计算为载体,考查可逆反应的不完全性,注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物.


科目:高中化学 来源: 题型:选择题
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
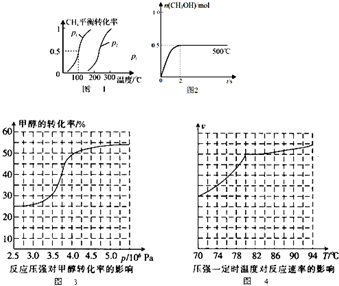
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
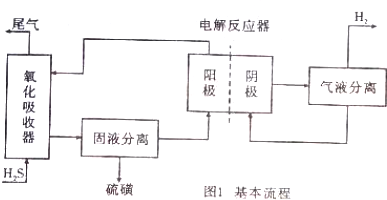
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
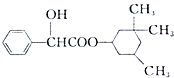 环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )
环扁桃酯具有松弛血管平滑肌、扩张血管的功能,其结构简式如图.下列对该物持的叙述中,正确的是( )| A. | 该物质属于芳香烃 | |
| B. | 该有机物难溶于水 | |
| C. | 分子式为C17H23 | |
| D. | 1mol该物质最多可与2molNaOH发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制备和收集氧气的实验装置 | |
| B. |  蒸馏海水的实验装置 | |
| C. | 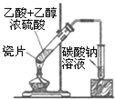 导气管插入碳酸钠溶液液面下可防止乙酸乙酯挥发 | |
| D. |  制取氢氧化亚铁时能观察到白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com