
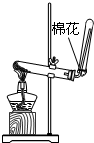
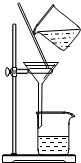
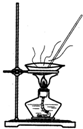
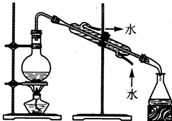
| A.用Ca(OH)2和 NH4Cl制取NH3 | B.从碘水中提取碘单质 | C.从食盐水中获取氯化钠 | D.用自来水制取蒸馏水 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Ca(OH)2和NH4Cl在加热条件下可生成NH3,氨气密度比空气小;
B.碘易溶于有机溶剂;
C.可用蒸发的方法分离氯化钠;
D.水易挥发,可用蒸馏的方法制备蒸馏水.
解答 解:A.Ca(OH)2和NH4Cl在加热条件下可生成NH3,氨气密度比空气小,反应生成水,试管口略向下倾斜,故A正确;
B.碘易溶于有机溶剂,应用萃取的方法分离,故B错误;
C.水易挥发,可用蒸发的方法分离氯化钠,故C正确;
D.水易挥发,可用蒸馏的方法制备蒸馏水,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的分离、制备等基本实验操作的考查,侧重于实验方案的评价,注意把握物质的性质以及操作要点,题目难度不大.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.打磨磁石制指南针 | B.烧结粘土制陶瓷 | C.湿法炼铜 | D.铁的冶炼 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 铁的状态 | 盐酸的浓度 | 反应的温度 |
| A | 片状 | 1 mol/L | 20℃ |
| B | 片状 | 3 mol/L | 40℃ |
| C | 粉末 | 1 mol/L | 20℃ |
| D | 粉末 | 3 mol/L | 40℃ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
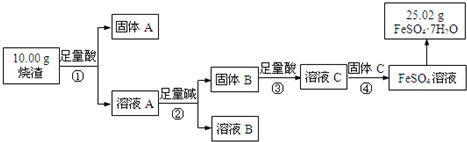
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com