
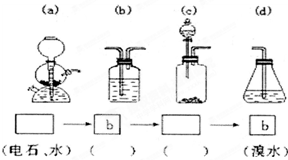
 为探究乙炔与溴的加成反应,
为探究乙炔与溴的加成反应,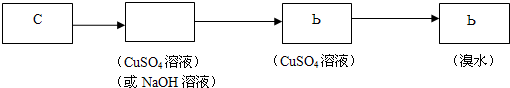 ,
, ;
;| 22.4L |
| VL |
| 64g |
| ag×90% |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
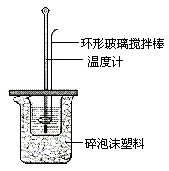 已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题
已知测定中和热的实验步骤如下:①量取30mL 0.5mol/L硫酸倒入小烧杯中,测量温度; ②量取50mL 0.5mol/L NaOH溶液,测量温度; ③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度.回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Fe2+ Ba2+ NH4+ |
| 阴离子 | OH- NO3- I- HSO3- AlO2- HSO4ˉ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| B、NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、pH=2的盐酸与pH=12的氨水以任意比例混合所得溶液中:c(H+)+c(NH4+)=c(OH-)+c(Cl-) |
| D、等物质的量浓度的CH3COOH和CH3COONa溶液等体积混合后所得溶液中:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ |
| B、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| C、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com