
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 反应前2 min的平均速率v(C)=0.004 mol/(L•min) | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v (逆)>v (正) | |
| C. | 其他条件不变,起始时向容器中充入0.64mol A和0.64mol B,平衡时n(C)<0.48mol | |
| D. | 其他条件不变,向平衡体系中再充入0.32mol A,再次平衡时,B的转化率增大 |
分析 由表格数据可知,7min达到平衡,则
A(g)+B(g)?2C(g)
开始 0.32 0.32 0
转化 0.12 0.12 0.24
平衡 0.2 0.2 0.24
A.结合v=$\frac{△c}{△t}$计算;
B.该反应为放热反应,降低温度,平衡正向移动;
C.温度、体积不变,起始时向容器中充入0.64mol A和0.64mol B,n与p成正比,p增大,平衡不移动;
D.其他条件不变,向平衡体系中再充入0.32mol A,平衡正向移动.
解答 解:A.由表格中B的变化,则反应前2 min的平均速率v(C)=$\frac{\frac{0.32mol-0.24mol}{10L}}{2min}$×2=0.008mol/(L•min),故A错误;
B.该反应为放热反应,降低温度,平衡正向移动,则反应达到新平衡前v (逆)<v (正),故B错误;
C.温度、体积不变,起始时向容器中充入0.64mol A和0.64mol B,n与p成正比,p增大,平衡不移动,平衡时n(C)=0.24mol×2=0.48mol,故C错误;
D.其他条件不变,向平衡体系中再充入0.32mol A,平衡正向移动,促进B的转化,则再次平衡时,B的转化率增大,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、平衡移动、速率及转化率计算为解答的关键,侧重分析与计算能力的考查,注意选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 向冰醋酸中逐滴加水,醋酸的电离度和pH先增大后减小 | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 25℃时,在CH3COOH溶液与NaCN溶液中,水的电离程度前者大 | |
| D. | amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)<c(CN-),则b一定小于a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>X | |
| B. | 含氧酸的酸性:W>Z | |
| C. | 气态氢化物的稳定性:W<Y | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 0.1mol•L-1NaOH溶液中通入SO2气体至pH=7:c(Na+)=c(HSO3-)+2 c(SO32-)+c(H2SO3) | |
| C. | 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol•L-1 | |
| D. | 20 mL0.1mol•L-1CH3COONa溶液与10 mL 0.1mol•L-1HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
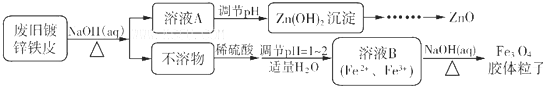
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
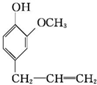 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: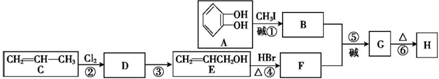
 (X代表卤素原子);
(X代表卤素原子);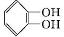 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$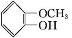 +HI.
+HI.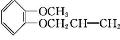 .
.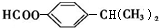 (任写一种).
(任写一种).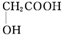 )及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯:
)及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯: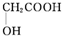 $\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$
$\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$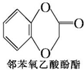
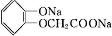 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
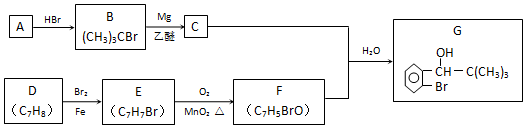

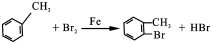 ;F的结构简式为
;F的结构简式为 .
.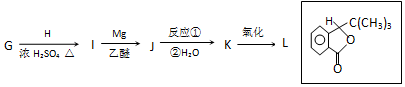
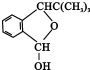 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 部分信息 |
| X | X的单质由双原子分子构成,分子中有14个电子 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 |
| Z | Z元素的最高正化合价与最低负化合价的代数和等于6 |
| W | 地壳中含量最多的金属元素 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com