
在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g)2HI(g)。
(1)反应刚开始时,由于c(H2)=________,c(I2)=________,而c(HI)=________,所以化学反应速率________最大,而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v(正)________,而v(逆)________。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
科目:高中化学 来源: 题型:
硫酸氢钠(NaHSO4)通常为晶体,易溶于水。硫酸氢钠溶于水电离出三种不同的离子,溶液显酸性;硫酸氢钠受热熔化后只能电离出两种不同的离子。
(1)硫酸氢钠在水中电离的方程式是_________________________________。
(2)硫酸氢钠在熔融状态下电离的方程式是______________________________。
(3)下列说法中,正确的是________。
A.硫酸氢钠属于酸 B.硫酸氢钠属于盐
C.硫酸氢钠属于电解质 D.硫酸氢钠溶液跟锌单质反应生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是( )
A.锌片插入硝酸银溶液中Zn+Ag+===Zn2++Ag
B.碳酸氢钙溶液加到醋酸中
Ca(HCO3)2+2CH3COOH===Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中
Na+2H2O===Na++OH-+H2↑
D.氢氧化铜加到盐酸中
Cu(OH)2+2H+===Cu2++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是可逆反应X2+3Y22Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A.t1时,只有正方向反应
B.t1~t2时,X2的物质的量越来越多
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
采用不同的分类方法,可以将非金属氧化物分为不同的类型。例如从某种角度上讲可将CO2、SO3、P2O5、Cl2O7等归为一类,则下列氧化物中与它们同属于一类的是( )
A.NO2 B.NO C.N2O5 D.CO
查看答案和解析>>
科目:高中化学 来源: 题型:
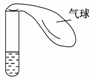
某学生课外活动小组利用右图所示装置分别进行如下实验:
(1)向试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是______________溶液;加热时溶液由红色逐渐变浅的原因是_______________。
(2)向试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则原溶液可能是____________________溶液;加热时溶液由无色变为红色的原因是_____________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是重要的化工原料,二氧化硫生成三氧化硫是硫酸工业的重要反应之一。
(1)将0.100 mol SO2(g)和0.060 mol O2(g)放入容积为2 L的密闭容器中,反应2SO2(g)+O2(g)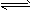 2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下5分钟末达平衡状态,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是____ ▲ ____;
②列式并计算该条件下反应的平衡常数K=____ ▲ ____。
③已知:K(300℃)>K(350℃),若反应温度升高,SO2的转化率____ ▲ ____(填“增大”、“减小”或“不变”)。
④能判断该反应达到平衡状态的标志是____ ▲ ____。(填字母)
A.SO2和SO3浓度相等 B.容器中混合气体的平均分子量保持不变
C.容器中气体的压强不变 D.SO3的生成速率与SO2的消耗速率相等。
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如下图1所示。平衡状态由A变到B时,平衡常数K(A)___ ▲ ____K(B)(填“>”、“<”或“=”)。
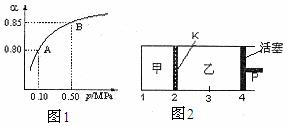
(3)如图2所示,保持温度不变,在一定反 应条件下,将2molSO2和1molO2加入甲容器中,将4molSO2和2molO2加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲_ ▲ 乙。(填:“大于”、“小于”、或“等于”)
②若在甲容器中通入一定量的He气,使容器内的压强增大,则c(SO3)/c(SO2)将__ _ ▲ ____填:“增大”、“减小”、“不变”、“无法确定”)
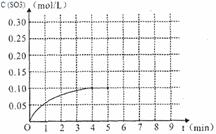 (4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
(4)将一定量的SO2(g)和O2(g)放入某固定体积的密闭容器中,在一定条件下,c(SO3)的变化如下图所示。若在第5分钟将容器的体积缩小一半后,在第8分钟达到新的平衡(此时SO3的浓度约为0.25mol/L)。请在下图中画出此变化过程中SO3浓度的变化曲线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com