
| 化学键 | H-H | O=O |
| 键能/kJ/mol | 436 | 498 |
| A. | 463.4kJ/mol | B. | 926.8kJ/mol | C. | 221.6kJ/mol | D. | 413kJ/mol |
分析 水的结构式为H-O-H,2mol水分子中含有4molH-O键,2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,反应物总键能-生成物总键能=反应热,据此计算O-H键的键能.
解答 解:水的结构式为H-O-H,2mol水分子中含有4molH-O键,2H2(g)+O2(g)═2H2O(g)△H=-483.6KJ/mol,反应物总键能-生成物总键能=反应热,则:436kJ/mol×2+498kJ/mol-4E(O-H)=-483.6KJ/mol,故E(O-H)=463.4kJ/mol,
故选A.
点评 本题考查反应热的有关计算,难度不大,注意掌握反应热与键能的关系,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 萃取操作时,选择的萃取剂的密度必须比水大 | |
| D. | 分液操作时,上层液体从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
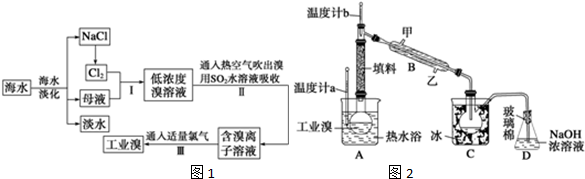
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
科学家利用太阳能分解水生产的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH).已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为285.8kJ•mol-1、283.0kJ•mol-1和726.5kJ•mol-1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠保存在煤油中 | |
| B. | 白磷保存在水中 | |
| C. | 在FeCl3 溶液中加入一定量铁粉,防止溶液变质 | |
| D. | 为了检验FeCl2溶液是否变质,可用KSCN 溶液检验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+) | |
| B. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①>③>② | |
| C. | 0.1 mol•L-1的NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 标准状况下将2.24L CO2气体通入150mL 1mol•L-1的NaOH溶液中,充分反应后溶液中c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.7mol Na2O2与足量的CO2气体反应,电子转移0.7NA | |
| B. | 足量水蒸气与16.8gFe粉反应转移0.9mol电子 | |
| C. | Na与水、Al与NaOH溶液反应中水均作氧化剂 | |
| D. | 用钠从四氯化钛中置换钛,利用了钠的强还原性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com