
科学家最近发现两种粒子:第一种是只由四个中子构成的粒子(假设符号为X),这种粒子称为“四中子”,也有人称之为“零号元素”,第二种是由四个氧原子构成的分子,下列有关这两种粒子的说法不正确的是 ( )
A.“四中子”不显电性,化学符号可以表示为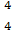 X
X
B.“四中子”的质量数为4,其质量比氢原子大
C.第二种粒子是氧元素的另一种同位素
D.第二种粒子的化学式为O4,与O2互为同素异形体
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生 反应,说明亚硝酸钠具有 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具
有 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F====6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是 ,还原剂是 ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为 ,
反应中每生成0.1 mol H2,转移电子数为 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明一氧化碳具有还原性,有人设计了下列实验:
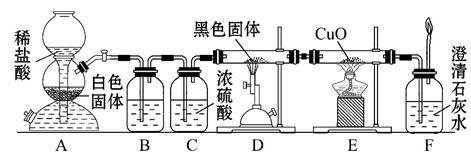
(1)装置B中最适宜的试剂是_________ 。
(2)装置D中发生反应的化学方程式是 _______。
(3)必须用装置C吸收除去气体中水蒸气的理由是____________。
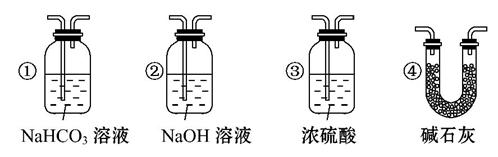
(4)若根据F中石灰水变浑浊的现象也能确定CO具有还原性,应在上图中装置______与 之间连接下列装置中的 (填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年国庆长假京城大堵车的场面“蔚为壮观”,大量汽车尾气(含CO、SO2和NO等)的排放带来了严重的城市空气污染,治理的方法之一是在汽车的排放管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
(1)汽车尾气中导致酸雨形成的主要物质是 。
(2)写出在催化剂的作用下CO跟NO反应的化学方程式: 。
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
__________________________________________________________________。
(4)下列各项措施中,有利于缓解城市空气污染的有 (填序号)。
A.充分利用太阳能,减少能源消耗
B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境
D.取缔燃煤炉和木炭烧烤,改用天然气
查看答案和解析>>
科目:高中化学 来源: 题型:
)科学研究表明,月球上有丰富的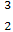 He资源,可开发利用作未来的新型能源。
He资源,可开发利用作未来的新型能源。
(1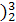 He的中子数是
He的中子数是 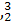 He与
He与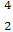 He互称为 。
He互称为 。
(2)α粒子是带有2个单位正电荷、质量数为4的原子核,由此推断α粒子含有
个质子和 个中子。
(3)在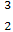 He
He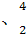 He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
He两种核素中,原子核内的中子数之差为 ,与α粒子有相同质子数和中子数的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组顺序的排列不正确的是( )
A.熔点:金刚石>食盐>干冰 B.热稳定性:HCl>H2S>PH3
C.沸点:HF>HBr>HCl D.离子半径:Na+<Mg2+<Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20ml恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值_________和A值___________
(2)X元素在周期表中的位置__________________________________;
(3)写出X单质与水反应的化学方程式._____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的( )
|
| A. | 化学反应速率大小的决定因素是反应物的性质 |
|
| B. | 所有化学反应,温度升高其反应速率一定增大 |
|
| C. | 钢铁腐蚀、熟料老化、食物腐败等都是化学变化,减小这些反应的速率有利于生产、生活及可持续发展 |
|
| D. | 硫酸工业、硝酸工业、铁的冶炼等都涉及到化学反应且都会产生污染,减小这些反应的速率有利于降低对环境的污染也有利于国民经济的可持续发展 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com