
【题目】(1)请用化学方程式解释下列现象:
①硝酸久置成黄色的原因:___________________________________________
②氨气溶于水使无色酚酞变红的原因: _____________________________________
(2)铁粉与过量的稀硝酸常温下可以发生如下反应:
Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
当铁粉过量时,在标准状况下反应生成2.24LNO气体,反应后溶液的溶质为________,则一共有______g铁参加反应,被还原的HNO3与未被还原的硝酸物质的量之比等于______________。
【答案】 4HNO3![]() 4NO2↑+O2↑+2H2O NH3 + H2O ≒ NH3·H2O ≒ NH4+ + OH- Fe(NO3)2 8.4g 1:3
4NO2↑+O2↑+2H2O NH3 + H2O ≒ NH3·H2O ≒ NH4+ + OH- Fe(NO3)2 8.4g 1:3
【解析】(1)①硝酸见光易分解,久置成黄色,方程式为4HNO3![]() 4NO2↑+O2↑+2H2O;②氨气溶于水生成的一水合氨电离出氢氧根,溶液显碱性,使无色酚酞变红,方程式为 NH3 + H2O
4NO2↑+O2↑+2H2O;②氨气溶于水生成的一水合氨电离出氢氧根,溶液显碱性,使无色酚酞变红,方程式为 NH3 + H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-;(2)当铁粉过量时生成硝酸亚铁,即反应后溶液的溶质为Fe(NO3)2;在标准状况下反应生成2.24LNO气体,NO是0.1mol,转移0.3mol电子,根据电子得失守恒可知消耗铁是0.3mol÷2=0.15mol,质量是0.15mol×56g/mol=8.4g。生成硝酸亚铁是0.15mol,则未被还原的硝酸物质的量是0.3mol,所以被还原的HNO3与未被还原的硝酸物质的量之比=0.1mol:0.3mol=1:3。
NH4+ +OH-;(2)当铁粉过量时生成硝酸亚铁,即反应后溶液的溶质为Fe(NO3)2;在标准状况下反应生成2.24LNO气体,NO是0.1mol,转移0.3mol电子,根据电子得失守恒可知消耗铁是0.3mol÷2=0.15mol,质量是0.15mol×56g/mol=8.4g。生成硝酸亚铁是0.15mol,则未被还原的硝酸物质的量是0.3mol,所以被还原的HNO3与未被还原的硝酸物质的量之比=0.1mol:0.3mol=1:3。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】已知常温常压下,N≡N 键的键能是 946 kJ/mol、N-H 键的键能是391 kJ/mol、H-H 键的键能是 436 kJ/mol.现有甲、乙两个容积相同的定容密闭容器,在常温下: ①向密闭容器甲中通入1mol N2 和3mol H2,达到平衡时放出热量 Q1kJ. ②向密闭容器乙中通入0.5mol N2 和 1.5mol H2,达到平衡时放出热量 Q2 kJ.则下列关系式正确的是( )
A. 92>Ql>2Q2 B. 92=Q1<2Q2 C. Q1=2Q2=92 D. Q1=2Q2<92
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的起始浓度和平衡浓度如下表,下列说法错误的是( )
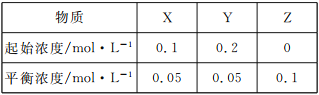
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y![]() 2Z,平衡常数为1600
2Z,平衡常数为1600
C.其他条件不变时,增大压强可使平衡常数增大
D.改变温度可以改变该反应的平衡常数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com