
【题目】铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:
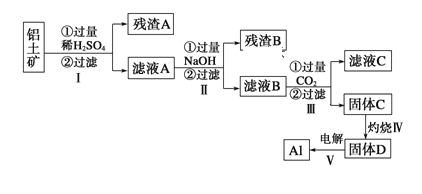
(1)滤液A加过量NaOH离子方程式表示为______________________________
(2)灼烧时盛放药品的仪器名称是_______
(3)步骤Ⅳ中发生反应的化学方程式是___________________________________
(4)步骤Ⅲ中生成固体C的离子反应方程式为_____________________________
(5)取滤液B 100mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7g,则滤液B中c(AlO2-)____mol/L,c(Na+)____6 mol/L (填“大于”、“小于”或“等于”)
【答案】H++OH-=H2O 4OH-+Al3+=AlO2-+2H2O、Fe3++3OH- = Fe(OH)3↓; 坩埚 2Al(OH)3![]() Al2O3+3H2O AlO2-+CO2+2H2O =Al(OH)3↓+HCO3- 1.5 大于
Al2O3+3H2O AlO2-+CO2+2H2O =Al(OH)3↓+HCO3- 1.5 大于
【解析】
铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)中加入过量的稀硫酸,氧化铝、氧化铁与硫酸反应生成硫酸铝和硫酸铁溶液,二氧化硅与硫酸不反应,所以过滤后残渣A为SiO2;滤液A为含有硫酸、硫酸铁和硫酸铝;滤液中加入过量的氢氧化钠溶液,生成氢氧化铁沉淀(残渣B),滤液B中含有氢氧化钠,偏铝酸钠和硫酸钠;通入过量二氧化碳气体,生成氢氧化铝沉淀(固体C),滤液C为碳酸氢钠、硫酸钠;固体C灼烧后生成氧化铝固体(D),电解熔融的氧化铝生成金属铝;据以上分析进行解答。
铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)中加入过量的稀硫酸,氧化铝、氧化铁与硫酸反应生成硫酸铝和硫酸铁溶液,二氧化硅与硫酸不反应,所以过滤后残渣A为SiO2;滤液A为含有硫酸、硫酸铁和硫酸铝;滤液中加入过量的氢氧化钠溶液,生成氢氧化铁沉淀(残渣B),滤液B中含有氢氧化钠,偏铝酸钠和硫酸钠;通入过量二氧化碳气体,生成氢氧化铝沉淀(固体C),滤液C为碳酸氢钠、硫酸钠;固体C灼烧后生成氧化铝固体(D),电解熔融的氧化铝生成金属铝;
(1)结合以上分析可知,滤液A为含有硫酸、硫酸铁和硫酸铝;滤液A加过量NaOH反应生成硫酸钠和偏铝酸钠,氢氧化铁沉淀,离子方程式为:H++OH-=H2O;4OH-+Al3+= AlO2-+ 2H2O、Fe3++3OH- =Fe(OH)3↓;
综上所述,本题答案是:H++OH-=H2O;4OH-+Al3+=AlO2-+ 2H2O、Fe3++3OH- =Fe(OH)3↓。
(2)结合以上分析可知,氢氧化铝固体灼烧时生成氧化铝,盛放药品的仪器名称是坩埚;
综上所述,本题答案是:坩埚。
(3)结合以上分析可知,氢氧化铝固体灼烧时生成氧化铝和水,步骤Ⅳ中发生反应的化学方程式是2Al(OH)3==Al2O3+3H2O;
综上所述,本题答案是:2Al(OH)3==Al2O3+3H2O。
(4)滤液B中偏铝酸钠溶液与过量二氧化碳气体反应生成生成氢氧化铝沉淀(固体C)和碳酸氢钠,步骤Ⅲ中生成固体C的离子反应方程式为AlO2-+ CO2+2H2O = Al(OH)3↓+ HCO3-;
综上所述,本题答案是:AlO2-+ CO2+2H2O =Al(OH)3↓+ HCO3-。
(5)取滤液B中含有氢氧化钠,偏铝酸钠和硫酸钠;加入盐酸生成11.7g Al(OH)3,物质的量为11.7/78=0.15mol,即n(AlO2-)=0.15mol,c(AlO2-)=0.15mol/0.1L=1.5mol/L;最后所得溶液为氯化钠和硫酸钠,根据钠离子守恒有:n(NaOH)=n(NaCl)+2(Na2SO4),根据氯离子与硫酸根离子守恒有n(NaCl)=n(HCl)=0.2×1=0.2mol,n(Na2SO4)=n(H2SO4)>3n[Al2(SO4)3)] =3×0.15mol=0.45mol;故n(NaOH)=n(NaCl)+2(Na2SO4)>0.2+2×0.45=1.1mol;故c(Na+)=1.1mol/0.1=11 mol/L大于6 mol/L;
综上所述,本题答案是:1.5;大于。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】下列物质:①丁烷 ②2-甲基丙烷 ③戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷沸点由大到小的排列顺序正确的是( )
A. ①>②>③>④>⑤B. ⑤>④>③>②>①
C. ③>④>⑤>①>②D. ②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第二周期元素A和B能形成键角为180°的AB2气体分子,则下列推断正确的是( )
A. AB2分子的空间构型为直线形
B. AB2分子为极性分子
C. 熔点、沸点:AB2>H2O
D. AB2与SiO2的结构相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
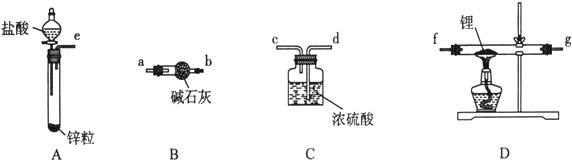
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,在碱性溶液里能大量共存,并且溶液为无色透明的是( )
A.K+ MnO4- Cl- SO42-B.Na+ K+ Al3+ Ba2+
C.Na+ HCO3- NO3- SO42-D.Na+ SO42- S2- Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理。
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3。
①溶液中粒子种类:Na2CO3溶液_____NaHCO3溶液(填“>”、“<”或“=”)。
②已知25℃时CO32-第一步水解的平衡常数K1=2×10-4mol/L.溶液中c(HCO3-):c(CO32-)=20:1时,溶液的pH=______。
③泡沫灭火器中通常装有NaHCO3溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________。
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得IL溶液A,溶液B为0.1mol/LCH3COONa溶液,则两份溶液中c(NO3-)、c( NO2-)和c(CH3COO-)由小到大的顺序为___________(已知HNO2的电离常数Ka=7.1×10-4mol/L,CH3COOH的电离常数Ka=1.7×10-5mol/L)。可使溶液A和溶液B的pH相等的方法是_____(填字母序号)。
A.向溶液A中加适量水 B.向溶液A中加适量NaOH
C.向溶液B中加适量水 D.向溶液B中加适量NaOH
(3) SO2会引起酸雨,可利用氢氧化钠溶液吸收,吸收SO2的过程中,pH随n(SO32-)、n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显_______性,用化学平衡原理解释:______________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):____
a. c(Na+)=2c(SO32-) +c(HSO3-)
b. c(Na+)>c(HSO3-)>c(SO32-)>c(H+) = c(OH-)
c.(Na+)+c(H+)=c(SO32-)+c(HSO3-) +c(OH-)
③当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
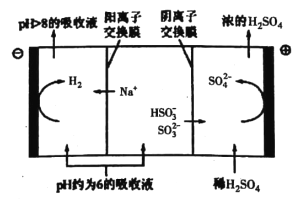
HSO3-在阳极放电的电极反应式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是

A.②和④处 B.只有②处 C.②和③处 D.②③④处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰晶石(Na3AlF6)微溶于水,工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
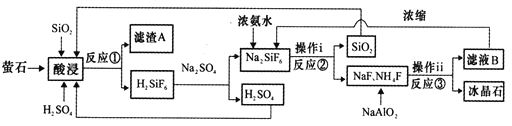
(1)Na3AlF6中氟、铝以共价键结合,写出Na3AlF6中所含阳离子的电子式________________,滤渣A的主要成分是_______________________(填名称)。
(2)为探究适合“酸浸”的条件,取4份相同样品进行实验,所得结果如下表所示:
实验编号 | 萤石品位 | 硫酸的 | 反应温度/℃ | 获得 Na2SiF6的质量 |
(CaF2含量) | 质量分数 | |||
1 | 96% | 25% | 60~70 | 120 |
2 | 96% | 35% | 60~70 | 153 |
3 | 96% | 35% | 80~90 | 100 |
4 | 96% | 40% | 60~70 | 141 |
①实验3比实验2获得Na2SiF6的质量低的原因可能是___________________。
②选择“酸浸”时所采用的最适合条件为____________________________。
(3)写出反应③的离子方程式:______________________________。
(4)“操作ⅰ”不能用硅酸盐质设备进行分离的原因__________________________。
(5)经测定,操作ⅰ所得滤液中所含杂质中K+浓度为0.05mol·L-1,当Na+浓度降为0.01mol·L-1时,若不考虑其它离子影响和溶液体积变化,K+___________(填“是”或“否”)开始沉淀。(已知25℃时,Ksp(Na3AlF6)=4.0×10-10,Ksp(K3AlF6)=6.0·10-8)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com