
分析 (一)(1)分析反应中元素化合价变化,找出化合价升高的和化合价降低的元素,依据氧化还原反应得失电子守恒规律结合原子个数守恒配平方程式;
根据所含元素化合价升高的反应物为还原剂,其对应的产物为还原产物,所含元素化合价降低的反应物为氧化剂,对应还原产物,结合离子方程式计算转移电子数目;
(3)依据方程式:6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,计算解答;
(二)(1)NaCN为强碱弱酸盐,水解生成HCN和氢氧化钠;
氰化钠与双氧水发生氧化还原反应生成碳酸氢钠和氨气;
(3)HCN酸性非常弱,依据强酸制备弱酸原理分析解答.
解答 解:(一)(1)NO3-中氮的化合价由+5价降低为0价,变化5,Al的化合价由0价升高为+3价,变化3,要使氧化还原反应得失电子守恒,则硝酸根硝酸根系数为6,铝系数为10,依据原子个数守恒反应方程式为:6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,
故答案为:6、10、18、3、10、6;
6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-中,铝化合价升高,失去电子;硝酸根离子中N化合价降低,硝酸根为氧化剂,对应产物氮气为还原产物;依据6NO3-~3N2~30e-,可知每生成1mol还原产物,转移电子数为10mol,个数为10NA;
故答案为:Al;N2;10NA;
(3)因为含氮0.3mol的废水中的NO3-的物质的量为0.3mol,根据化学方程式6NO3-+10Al+18H2O═3N2↑+10Al(OH)3+6OH-,0.3mol的硝酸根离子消耗金属铝的物质的量为$\frac{0.3mol×10}{6}$=0.5mol,
故答案为:0.5mol;
(二)(1)NaCN为强碱弱酸盐,水解生成HCN和氢氧化钠,离子方程式:CN-+H2O?HCN+OH-;
故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水发生氧化还原反应生成碳酸氢钠和氨气,化学方程式:NaCN+H2O2+H2O=NaHCO3+NH3↑;
故答案为:NaCN+H2O2+H2O=NaHCO3+NH3↑;
(3)HCN酸性非常弱,酸化的高锰酸钾中含有大量氢离子,依据强酸制备弱酸原理能生成大量有毒的HCN,方程式:NaCN+H2SO4=Na2SO4+HCN;
故答案为:不能;酸化的高锰酸钾中的氢离子与NaCN反应生成HCN,即NaCN+H2SO4=Na2SO4+HCN.
点评 本题考查了离子方程式的配平、氧化还原反应、水解反应等,题目涉及的知识点较多,侧重于考查学生对基础知识的应用能力,题目难度中等,注意把握氧化还原反应的分析方法.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入氯气:Cl2+OH-═ClO-+Cl-+H2O | |
| B. | 铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+ | |
| C. | 氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | 碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO${\;}_{3}^{-}$═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2蒸气、HI组成的平衡体系加压后颜色变深 | |
| B. | 在沸腾的蒸馏水中滴加饱和FeCl3溶液,制Fe(OH)3胶体 | |
| C. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| D. | 用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2中混有HCl:将其通入Na2SO3溶液 | |
| B. | NaHCO3溶液中混有少量的Na2CO3:往该溶液中通入过量的CO2气体 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 | |
| D. | FeCl2溶液中混有少量FeCl3:加入适量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片与稀盐酸制取H2:2Fe+6H+═2Fe3++3H2↑ | |
| B. | HNO3溶液中加入NaOH溶液:H++OH-═H2O | |
| C. | 向硫酸铁溶液中加入铁钉:Fe3++Fe═2Fe2+ | |
| D. | 向AlCl3溶液中加入过量NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
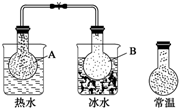 已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )
已知反应:2NO2(g)?N2O4(g),把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用夹子夹住橡皮管,把烧瓶A放入热水里,把烧瓶B放入冰水里,如图所示.与常温时烧瓶内气体的颜色进行对比发现,A烧瓶内气体颜色变深,B烧瓶内气体颜色变浅.下列说法错误的是( )| A. | 反应2NO2(g)?N2O4(g)的正反应为吸热反应 | |
| B. | 上述过程中,A烧瓶内正、逆反应速率均加快 | |
| C. | 上述过程中,B烧瓶内c(NO2)减小,c(N2O4)增大 | |
| D. | 上述过程中,A、B烧瓶内气体密度均保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
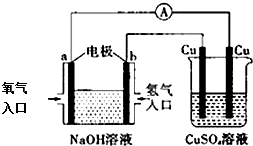
| A. | 该装置中a极为负极 | |
| B. | 该装置中b极的电极反应式是:2H++2e-=H2↑ | |
| C. | 一段时间后,左边装置中溶液pH增大 | |
| D. | CuSO4溶液浓度保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com