
| A. | 最高正价B<A=C | |
| B. | A、B形成的化合物中只含有离子键,A、C形成的化合物中只含有共价键 | |
| C. | A、B、C三种元素能组成两种不同的化合物 | |
| D. | A、C形成的一种化合物既有氧化性又有还原性 |
分析 A、B、C是短周期的三种元素,原子序数依次递增,A、C同主族;A、C形成的化合物中A的质量分数为50%或60%,二者形成的化合物为SO2、SO3,A为O元素、C为S元素;A、B形成的化合物中,A的质量分数为40%,该化合物为MgO,B为Mg元素,据此解答.
解答 解:A、B、C是短周期的三种元素,原子序数依次递增,A、C同主族;A、C形成的化合物中A的质量分数为50%或60%,二者形成的化合物为SO2、SO3,A为O元素、C为S元素;A、B形成的化合物中,A的质量分数为40%,该化合物为MgO,B为Mg元素.
A.B为Mg元素,最高价正化合价为+2,C为S元素,最高价正化合价为+6,A为O元素,没有最高正化合价,故A错误;
B.A、B形成的化合物为MgO,只含有离子键,A、C形成的化合物为SO2、SO3,只含有共价键,故B正确;
C.A、B、C三种元素能组成可以组成硫酸镁、亚硫酸镁等不同的化合物,故C正确;
D.A、C形成的一种化合物SO2既有氧化性又有还原性,故D正确,
故选A.
点评 本题考查元素化合物推断,属于猜测验证型题目,需要学生熟练掌握元素化合物知识,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 254gI2(g)中通入2g H2(g),反应放热9.48kJ | |
| B. | 反应(ii)的反应物总能量比反应(i)的反应物总能量低 | |
| C. | 反应(i)的产物比反应(ii)的产物稳定 | |
| D. | 1mol固态碘与1mol气态碘所含的能量相差17.00kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
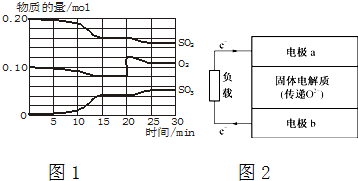
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| B. | 用石膏或盐卤点制豆腐 | |
| C. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| D. | 氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
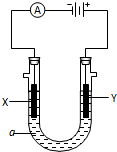 某化学实验小组需要2mol•L-1的NaCl溶液98ml,现用NaCl固体来配制,请回答下列问题:
某化学实验小组需要2mol•L-1的NaCl溶液98ml,现用NaCl固体来配制,请回答下列问题: ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个甘氨酸分子中存在9对共用电子对(甘氨酸的结构简式为NH2-CH2-COOH) | |
| B. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | H2S和CS2分子都是含极性键的极性分子 | |
| D. | 熔点由高到低的顺序是:金刚石>碳化硅>晶体硅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com