
���ܱ������У���1.0molCO��1.0molH2O��ϼ��ȵ�800�棬�������з�Ӧ��
CO(g)+H2O(g)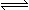 CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
CO2(g)+H2(g)��һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5mol����
(1)�ﵽƽ��ʱCO2�����ʵ��������÷�Ӧ�Ļ�ѧƽ�ⳣ����
(2)�ﵽƽ������ƽ����ϵ��ͨ��1.0molˮ�������ﵽ�µ�ƽ��״̬ʱ����ˮ���������ʵ�����CO2�����ʵ���������
(1)25% 1
(2)1.33mol 22.22%
��������
���������
CO(g) + H2O(g) 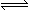 CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
��ʼ���ʵ����� 1.0mol 1.0mol 0 0
ת���� x x x x
ƽ�����ʵ����� (1-x)mol (1-x)mol x x
�������֪�� x=0.5mol
�ﵽƽ��ʱCO2�����ʵ�������Ϊ��x/2=0.25=25%
�÷�Ӧ�Ļ�ѧƽ�ⳣ��: 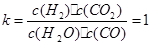
��
CO(g) + H2O(g) 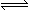 CO2(g)
+ H2(g)
CO2(g)
+ H2(g)
ƽ��ʱ�����ʵ�Ũ�ȣ� 0.5mol 0.5mol 0.5mol 0.5mol
ͨ��1.0molˮ������ 0.5mol 1.5mol 0.5mol 0.5mol
ת���� y y y y
�ٴ�ƽ�⣺ ��0.5-y�� (1.5-y) (0.5+y) (0.5+y)
����ƽ�ⳣ���У�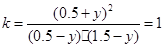
��֮�ã�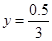
ˮ���������ʵ���:n(H2O)=1.5-0.5/3=4/3mol
CO2�����ʵ�������: 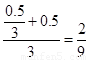
���㣺ƽ�ⳣ�����й�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ܱ������У���1.0 mol CO��1.0 mol H2O��ϼ��ȵ�800�棬�������з�Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5 mol��������˵����ȷ����
CO2��g��+H2��g����һ��ʱ���÷�Ӧ�ﵽƽ�⣬���CO�����ʵ���Ϊ0.5 mol��������˵����ȷ����
A��800���£��÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ0.25
B��427��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ9.4����÷�Ӧ�ġ�H��0
C��ͬ���£����������ƽ����ϵ��ͨ��1.0 mol��H2O��g������ƽ��ʱCOת����Ϊ66.7%
D��ͬ���£����������ƽ����ϵ��ͨ��1.0 mol��CO��g������ƽ��ʱCO���ʵ�������Ϊ33.3%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com