
 ,X2Y
,X2Y
分析 有X、Y、Z三种元素:(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色,说明是氢气在氯气中燃烧生成氯化氢,X为H2,Z为Cl2,生成XZ为HCl;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红,说明Z是HCl,溶于水形成盐酸溶液;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体判断为H2O,所以Y为O;
(5)Z单质溶于X2Y中所得溶液具有漂白性,是氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,据此进行解答.
解答 解:依据题干信息分析,有X、Y、Z三种元素:
(1)X、Y、Z的单质在常温下均为气体;
(2)X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色,说明是氢气在氯气中燃烧生成氯化氢,X为H2,Z为Cl2,生成XZ为HCl;
(3)XZ极易溶于水,在水溶液中电离出X+和Z-,其水溶液能使蓝色石蕊试纸变红,说明Z是HCl,溶于水形成盐酸溶液;
(4)每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体判断为H2O,所以Y为O;
(5)Z单质溶于X2Y中所得溶液具有漂白性,是氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,
(1)上述分析判断可知,X为H元素,Y为O元素,Z为Cl元素;
XZ为HCl,氯化氢为共价化合物,氯原子最外层达到8个电子稳定结构,氯化氢的电子式为 ;
;
H2Y化学式为H2O,水分子为共价化合物,其电子式为 ,
,
故答案为:H;O;Cl; ;
; ;
;
(2)化合物XZ为HCl,氯化氢为强电解质,在溶液中完全电离,其电离方程式为:HCl=H++Cl-,
故答案为:HCl=H++Cl-;
(3)Z单质溶于X2Y中发生反应是氯气和水反应生成盐酸和次氯酸,反应的离子方程式为:Cl+H2O=H++Cl-+HClO,
故答案为:Cl+H2O=H++Cl-+HClO.
点评 本题考查无机物的推断,题目难度中等,注意根据物质的颜色、状态作为推断的突破口,旨在考查学生对基础知识的积累与熟练程度,试题培养了学生的分析、理解能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
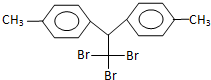 ,有关它的说法正确的是( )
,有关它的说法正确的是( )| A. | 它属于芳香烃 | B. | 分子式为C16H14Br3 | ||
| C. | 分子中最多有24个原子共面 | D. | 1mol该物质能与6mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由2H和18O所组成的水11 g,所含的中子数为4NA | |
| B. | 1 mol N2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,7.1 g氯气与足量石灰乳充分反应转移电子数为0.2NA | |
| D. | NO2和H2O反应每生成2 mol HNO3时转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
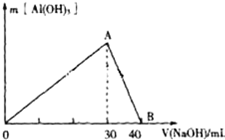 某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:
某无色废水中可能含有Fe3+、Al3+、Na+、Cl-、OH-、SO42-、中的几种离子.分别取三份废水进行如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 mol、30 mol | B. | 10 mol、10 mol | C. | 7.5 mol、7.5 mol | D. | 2.5 mol、2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol•L-1 Na2S溶液中一定有:c(OH-)=c(H+)+c(HS-)+2c(H2S) | |
| B. | 向NH4Cl溶液中加入适量氨水,得到的碱性混合溶液中一定有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 加热Na2S溶液,溶液c(OH-)肯定增大,c(H+)肯定减小 | |
| D. | 加水稀释0.1mol•L-1醋酸溶液,电离平衡向右移动,c(H+)一定减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe2+、Cl-、SO42- | B. | Na+、Cl-、CO32-、SO32- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | K+、AlO2-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com