
【题目】在2FeBr2+3Cl2===2FeCl3+2Br2的反应中,被氧化的元素是( )
A.Fe B.Br C.Fe和Br D.Cl
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的
A. 质量 B. 密度 C. 碳原子数 D. 原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组对NO与Na2 O2 的反应进行了探究。通过查阅资料可知:①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其它都易溶于水;③2NaNO3![]() 2NaNO2+O2↑,NaNO2 热稳定性很高。
2NaNO2+O2↑,NaNO2 热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
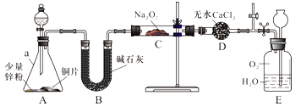
(1)装置B的作用是______________;
(2)在分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是____;
(3)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是_________________。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(4)提出假设:
假设1.白色固体只有NaNO3 ;
假设2.白色固体只有_________________;
假设3.白色固体是两种物质的混合物。
(5)实验验证:
①根据查阅的资料,要证明假设1是否成立,需要用到的试剂为____________________;
②为证明是假设2还是假设3成立,称取C中生成的白色固体m g置于坩埚中(坩埚质量为ag),用酒精灯加热至质量不再改变,若假设3成立,则冷却后称得剩余固体总质量n的范围是_______。(用含字母的不等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质中元素被还原了,则该元素一定( )
①化合价升高 ②化合价降低 ③得到电子或电子对偏向 ④失去电子或电子对偏离
A.①② B.②④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)![]() 2Z(g)、②2M(g)
2Z(g)、②2M(g)![]() N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
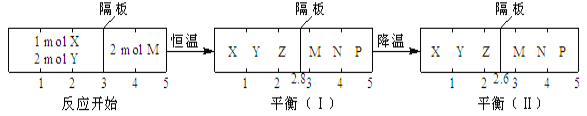
下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于
A. 2.0 B. 1.7 C. 12.0 D. 12.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气(主要成分CO2、CO、SO2、NOX) 的排放对环境有很大的影响。
I.利用氨水作吸收液是当前有效捕捉CO2的方法,经过可逆反应生成NH4HCO3。生成的NH4HCO3分解可得到CO2,从而实现吸收液的再生。
(1)写出氨水捕捉CO2 的化学方程式 。
(2)已知:NH4HCO3 溶液显碱性,下列说法不正确的是 。
a.c(NH3·H2O)>c(H2CO3)
b.c(NH4+)>c(HCO3—)>c(OH—)>c(H+)
c.c(NH3·H2O)+c(NH4+)=c(H2CO3)+c(HCO3—)
d.c(HCO3—)+2c(CO32—)+c(OH—)=c(H+)+c(NH4+)
(3)如图是氨水吸收CO2 的脱除率随温度变化的关系图。
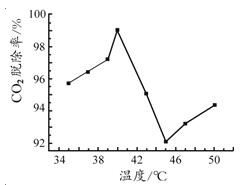
应用平衡移动原理分析 CO2 在 40℃-45℃ 脱除率降低可能的原因 。
II.SO2、NOX 可以经 O3 预处理后用 CaSO3 水悬浮液吸收,可减少烟气中SO2、NOX 的含量。O3 氧化烟气中 NOX 的主要反应的热化学方程式为:
(4)用CaSO3水悬浮液吸收烟气中NO2时,清液 ( pH约为8) 中SO32-将NO2转化为NO2-,其离子方程式为 。
(5)CaSO3水悬浮液中加入Na2SO4溶液能提高NO2 的吸收速率,用平衡移动原理解释其主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
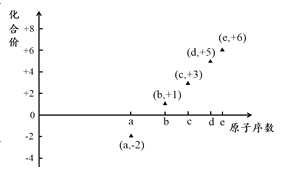
A. 31d和33d属于同种核素
B. 气态氢化物的稳定性:a>d>e
C. 工业上常用电解法制备单质b和c
D. a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料。某实验室对氨气进行下列研究。
(1)相同温度下,在三个体积均为2.0L的恒容密闭容器中发生反应:N2(g)+3H2(g) ![]() 2NH3(g),反应过程中测定的部分数据见下表:
2NH3(g),反应过程中测定的部分数据见下表:
容器编号 | 起始各物质的物质的量/mol | 平衡物质的量(mol) | 平衡压强(Pa) | ||
N2(g) | H2(g) | NH3(g) | NH3(g) | ||
Ⅰ | 4 | 12 | 0 | 4 | P1 |
Ⅱ | 2 | 6 | 0 | C2 | P2 |
Ⅲ | 1.5 | 4.0 | 3 | ? | ? |
①若容器Ⅰ中反应50秒到达平衡,则该时段v(H2)= mol/(L·s)
②容器Ⅰ、Ⅱ中反应均到达平衡时c2 2;p1 2p2(填“>”、“<”或“=”)
③容器Ⅲ中,达到平衡前v(正) v(逆) (填“>”、“<”或“=”)
(2)①已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g)=2NO(g) △H=180.5 kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ/mol
则4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);△H= KJ/mol
4NO(g)+6H2O(g);△H= KJ/mol
②将4molNH3和5molO2分别置于5个体积相同、温度不同的容器中在铂系催化剂作用下进行反应,相同时间后测量5个容器中N产率如图所示。下列说法正确的是 (填字母)。
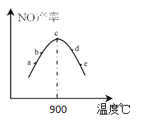
A.a点v(正)大于v(逆)
B.c点反应速率最快
C.温度高于900℃时,NO产率下降的原因是因为温度升高导致平衡逆向移动
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g)。则该燃料电池的负极反应式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com