
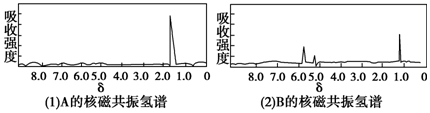
| A. | A是C3H8;B是C6H6 | B. | A是C4H10;B是C6H6 | ||
| C. | A是C3H6;B是C3H6 | D. | A是C3H6;B是C2H6 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 18 g D2O和18 g H2O中含有的质子数均为10 NA | |
| B. | 22.4 LC02中含有共价键数目4 NA | |
| C. | 若H2O2分解产生成0.1mol氧气转移的电子数为0.2 NA | |
| D. | 同温、同压同体积的CO和NO含有的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C≡O | C=O | C-H | H-H |
| 能量/kJ•mol-1 | 1074 | 803 | 413 | 436 |
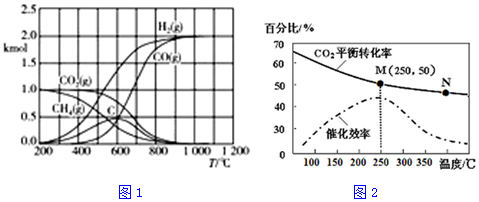
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
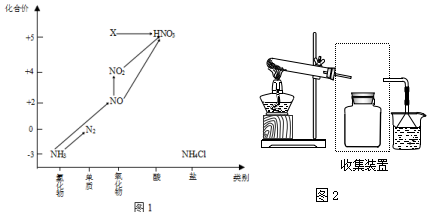
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.
Ⅰ.铁及铁的化合物应用广泛,如FeCl3可用作印刷电路铜版腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
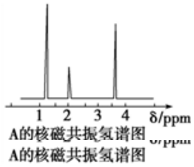
| A. | CH3CH2CH3 | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2O2中只含有极性共价键,不含离子键 | |
| B. | 2NO2?N2O4的平衡常数K随温度升高而减小 | |
| C. | 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 | |
| D. | H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com