
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+260 kJ·mol-1
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为_______________________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
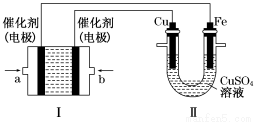
①a处应通入________(填“CH4”或“O2”),b处电极上发生的电极反应式是______________________________
②电镀结束后,装置Ⅰ中溶液的pH________(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________(忽略水解);
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷________L(标准状况下)。
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)
ΔH=-46 kJ·mol-1
(2)①CH4 O2+2H2O+4e-=4OH- ②变小
不变 ③CO ④1.12
④1.12
【解析】(1)根据盖斯定律,将第一个热化学方程式乘以2,与第二个相加得2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=-46 kJ·mol-1。
(2)由于Fe棒上镀Cu,则Cu棒发生氧化反应,作阳极,b电极作正极,a电极作负极,CH4在a处通入,O2在b处通入,由于KOH作电解质溶液,则b极反应式为O2+2H2O+4e-=4OH-;电镀过程中电解质溶液不参与电极反应,各离子浓度均不变;CH4燃料电池中的化学方程式为CH4+2O2+2KOH=K2CO3+3H2O,可得溶液中存在CO ,再由电子守恒得CH4~4Cu,则12.8 g Cu的物质的量为0.2 mol,消耗CH4为
,再由电子守恒得CH4~4Cu,则12.8 g Cu的物质的量为0.2 mol,消耗CH4为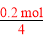 =0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L。
=0.05 mol,在标准状况下的体积为0.05 mol×22.4 L·mol-1=1.12 L。


科目:高中化学 来源:2014年高考化学苏教版一轮复习专练2 阿伏加德罗常数的判断练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )。
A.常温常压下,17 g甲基(—14CH3)所含的中子数为9 NA
B.标准状况下,11.2 L苯中含有的碳碳双键数为1.5 NA
C.42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3 NA
D.1 mol氯气与氢氧化钙溶液完全反应生成氯化钙和氯酸钙,转移的电子数为6 NA
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第3章 物质在水溶液中的行为练习卷(解析版) 题型:选择题
常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7 B.2.0C.12.0 D.12.4
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
把等物质的量的Na2SO4、NaCl、AgNO3混合物放入足量水中,经充分搅拌后,将
所得溶液用石墨电极进行电解,阳极生成的物质是( )
A.H2 B.AgC.Cl2 D.O2
查看答案和解析>>
科目:高中化学 来源:2014年高中化学鲁科版选修四第1章 化学反应与能量转化练习卷(解析版) 题型:选择题
在生产和生活中,人们广泛利用着化学反应释放的能量。下列说法正确的是( )
A.物质发生化学变化并不一定都伴随着能量变化
B.用实验方法和理论方法研究反应热的化学称为热化学
C.有能量变化的都是化学变化
D.任何反应中的能量变化都表现为热量变化
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
[双选题]为了配制NH 与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
与Cl-浓度比为1∶1的溶液,可在NH4Cl溶液中加入( )
A.适量的HCl B.通适量氨气
C.适量的氨水 D.适量的NaOH
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四模块综合检测练习卷(解析版) 题型:选择题
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
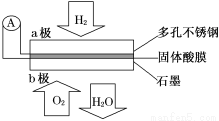
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为: O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷(解析版) 题型:选择题
莫尔盐[(NH4)2Fe(SO4)2·6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
A.c(SO )>c(NH
)>c(NH )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
B.c(SO )=c(NH
)=c(NH )>c(Fe2+)>c(H+)>c(OH-)
)>c(Fe2+)>c(H+)>c(OH-)
C.2c(SO )+c(OH-)=c(NH
)+c(OH-)=c(NH )+2c(Fe2+)+c(H+)
)+2c(Fe2+)+c(H+)
D.c(NH )+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
)+c(NH3·H2O)=2c(Fe2+)+2c[Fe(OH)2]
查看答案和解析>>
科目:高中化学 来源:2014年高中化学苏教版选修四专题1 化学反应与能量变化练习卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O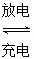 3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH。关于该电池的说法正确的是( )
A.放电时,Zn作负极,发生还原反应
B.放电时,K2FeO4附近溶液pH减小
C.充电时,锌极附近溶液pH减小
D.充电时,阳极电极反应为:
Fe(OH)3-3e-+5OH-=FeO +4H2O
+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com