
磷酸铁锂(LiFePO4)被认为是最有前途的锂离子电池正极材料。某企业利用富铁浸出液生成磷酸铁锂,开辟了处理硫酸亚铁废液一条新途径。其主要流程如下:
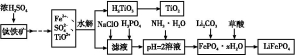
已知:H2TiO3是种难溶于水的物质。
(1)钛铁矿用浓硫酸处理之前,需要粉碎,其目的是 。
(2)TiO2+水解生成H2TiO3的离子方程式为 。
(3)加入NaClO发生反应的离子方程式为 。
(4)在实验中,从溶液中过滤出H2TiO3后,所得滤液浑浊,应如何操作 。
(5)为测定钛铁矿中铁的含量,某同学取经浓硫酸等处理的溶液(此时钛铁矿中的铁已全部转化为二价铁离子),采取KMnO4标准液滴定Fe2+的方法:(不考虑KMnO4与其他物质反应)在滴定过程中,若未用标准液润洗滴定管,则使测定结果 (填“偏高”、“偏低”或“无影响”),滴定终点的现象是 。滴定分析时,称取a g钛铁矿,处理后,用c mol/L KMnO4标准液滴定,消耗V mL,则铁元素的质量分数的表达式为 。
(1)增大固体的表面积,加快化学反应速率
(2)TiO2++2H2O H2TiO3+2H+
H2TiO3+2H+
(3)ClO-+2Fe2++2H+ 2Fe3+ +Cl- +H2O
2Fe3+ +Cl- +H2O
(4)换上新的过滤器,将浑浊滤液重新过滤
(5)偏高 滴加最后一滴KMnO4标准液,溶液变成紫红色,且在半分钟内不褪色为止  %
%
【解析】(1)粉碎的目的是增大固体与溶液反应时的接触面积,加快反应的进行。
(3)酸性条件下ClO-将Fe2+氧化为Fe3+,ClO-被还原成Cl-:ClO-+2Fe2++2H+ Cl-+2Fe3++H2O。
Cl-+2Fe3++H2O。
(4)滤液浑浊,说明过滤器损坏,应换上新过滤器后,重新过滤。
(5)如果未用标准液润洗滴定管,会导致标准液被稀释,消耗KMnO4标准液体积偏大,使测定结果偏高;当滴定达终点时,滴加最后一滴KMnO4标准液,溶液变成紫红色,且半分钟内不褪色。由Mn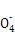 ~5Fe2+知,
~5Fe2+知,
w(Fe)=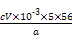 ×100%=
×100%= %。
%。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2014高考化学名师选择题专练 实验基础练习卷(解析版) 题型:选择题
某无色溶液中只可能含有①Na+、②Ba2+、③Cl-、④I-、⑤S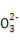 、⑥S
、⑥S 离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
离子中的若干种(忽略水电离出的H+、OH-),依次进行下列实验,且每步所加试剂均过量,观察到现象如下表。下列结论正确的是( )
步骤 | 操作 | 现象 |
① | 用pH试纸检验 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈紫红色 |
③ | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
④ | 过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
A.肯定含有的离子是③④⑤
B.肯定没有的离子是②⑤
C.不能确定的离子是③⑥
D.可能含有的离子是①⑥
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师选择题专练 元素周期表元素周期律练习卷(解析版) 题型:选择题
如图是部分短周期元素原子半径与原子序数的关系图,下列说法不正确的是( )
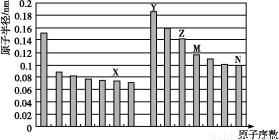
A.N、Z两种元素的离子半径相比前者较大
B.M、N两种元素的气态氢化物的稳定性相比后者较强
C.X与M两种元素组成的化合物能与碱反应,但不能与任何酸反应
D.工业上常用电解Y和N形成的化合物的熔融态制取Y的单质
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质结构与性质练习卷(解析版) 题型:填空题
(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
X | 578 | 1 817 | 2 745 | 11 578 |
Y | 738 | 1 451 | 7 733 | 10 540 |
Z | 496 | 4 562 | 6 912 | 9 543 |
则X、Y、Z的电负性从大到小的顺序为 (用元素符号表示),元素Y的第一电离能大于X的第一电离能的原因是
。
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小。D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C三原子都采取sp3杂化。
①A、B、C的第一电离能由小到大的顺序为 (用元素符号表示)。
②M是含有 键的 分子(填“极性”或“非极性”)。
③N是一种易液化的气体,请简述其易液化的原因:
。
④W分子的VSEPR模型的空间构型为 ,W分子的空间构型为 。
⑤AB-中和B2分子的π键数目比为 。
(3)E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4s1。
①E元素组成的单质的晶体堆积模型为 (填字母)。
a.简单立方堆积b.体心立方堆积
c.六方最密堆积d.面心立方最密堆积
②F元素在其化合物中最高化合价为 。
③G2+的核外电子排布式为 ,G2+和N分子形成的配离子的结构式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),主要工艺流程如下。
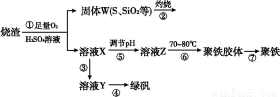
(1)将过程②产生的气体通入下列溶液中,溶液会褪色的是 。
A.品红溶液 B.紫色石蕊试液
C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS、O2和H2SO4反应的化学方程式为 。
(3)过程③中需加入的物质是 。
(4)过程④中,蒸发结晶时需使用的仪器除酒精灯、三脚架外,还需要 。
(5)过程⑤调节pH可选用下列试剂中的 (填序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80 ℃,目的是 。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.700 0 g样品;②将样品溶于足量的盐酸后,加入过量的BaCl2溶液;③过滤、洗涤、干燥,称重得固体质量为3.495 0 g。若该聚铁的主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 有机合成与推断练习卷(解析版) 题型:填空题
已知:Ⅲ能与NaHCO3溶液反应,Ⅲ和Ⅳ的相对分子质量相等且Ⅳ催化氧化的产物不能发生银镜反应。
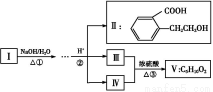
(1)化合物Ⅲ中官能团的名称是 ;Ⅱ不能发生的反应是 。
A.加成反应B.消去反应
C.酯化反应D.水解反应
(2)反应③的类型为 。
(3)Ⅴ的结构简式为 ,Ⅰ的结构简式为 。
(4)化合物Ⅵ是Ⅱ的同分异构体,同时符合下列四种条件,则Ⅵ的结构简式为 。
A.苯环上有两个取代基且苯环上的一氯代物有2种
B.能与FeCl3溶液发生显色反应
C.能发生水解反应
D.核磁共振氢谱有6个峰,峰的面积之比为1∶2∶2∶2∶2∶1
(5)化合物Ⅱ发生分子内成环反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
苯甲酸广泛应用于制药和化工行业。某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
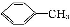 +2KMnO4
+2KMnO4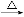
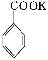 +KOH+
+KOH+
2MnO2↓+H2O
 +HCl
+HCl
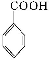 +KCl
+KCl
实验方法:一定量的甲苯和KMnO4溶液在100 ℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
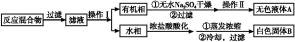
已知:苯甲酸分子量122,熔点122.4 ℃,在25 ℃和95 ℃时溶解度分别为0.3 g和6.9 g;纯净固体有机物一般都有固定熔点。
(1)操作Ⅰ为 ,操作Ⅱ为 。
(2)无色液体A是 ,定性检验A的试剂是 ,现象是 。
(3)测定白色固体B的熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体B加入水中,加热溶解, | 得到白色晶体和无色滤液 |
|
② | 取少量滤液于试管中, | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体, |
| 白色晶体 是苯甲酸 |
(4)纯度测定:称取1.220 g产品,配成100 mL甲醇溶液,移取25.00 mL溶液,滴定,消耗KOH的物质的量为2.40×10-3 mol。产品中苯甲酸质量分数的计算表达式为 ,计算结果为 (保留二位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:选择题
σ键可由两个原子的s轨道、一个原子的s轨道和另一个原子的p轨道或两个原子的p轨道以“头碰头”方式重叠构建而成。则下列分子中的σ键是由两个原子的s轨道以“头碰头”方式重叠构建而成的是( )
A.H2 B.HClC.Cl2 D.F2
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题7元素周期表与元素周期律练习卷(解析版) 题型:填空题
如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:
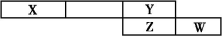
(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com